MENU
双性イオン(定義や特徴、酸・塩基との反応など)
目次
はじめに
【プロ講師解説】このページでは『双性イオン(定義や特徴、酸・塩基との反応など)』について解説しています。
双性イオンとは
- アミノ酸は分子内にカルボキシ基(-COOH)とアミノ基(-NH2)を併せもっており、酸性を示す-COOHから塩基性を示す-NH2にH+が移動し、分子内で塩を形成することがある。
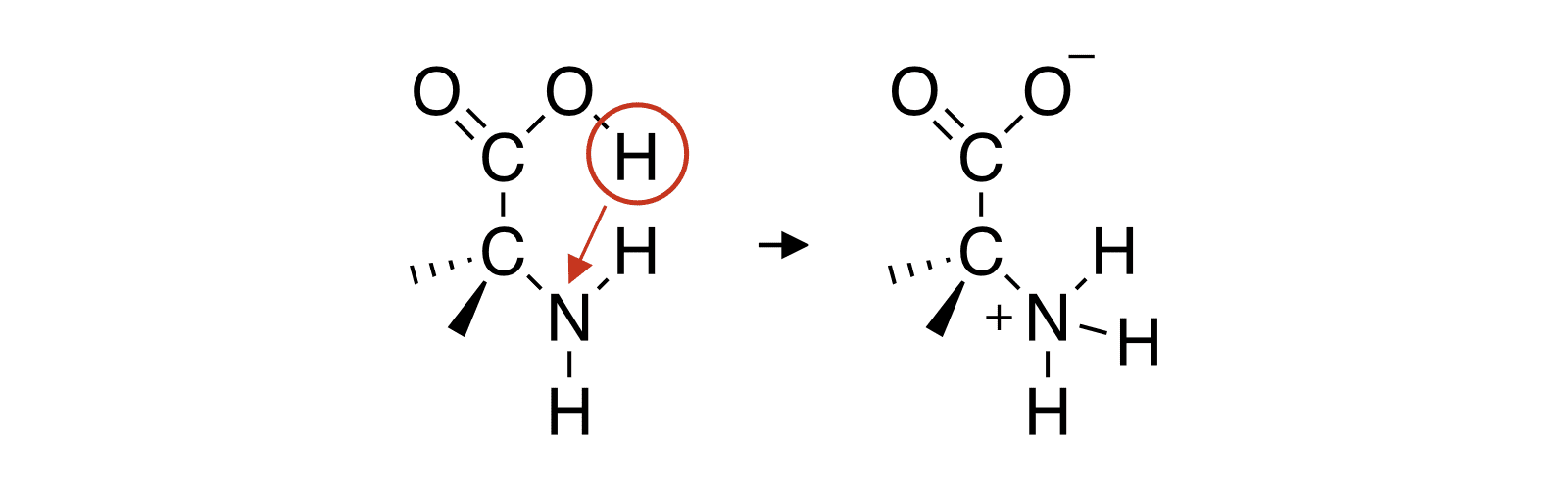
- このとき生じる正電荷と負電荷をもつイオンを双性イオンという。
- 双性イオンはクーロン力(静電引力)でお互いを引き合い、アミノ酸の結晶を形成する。
- したがって、アミノ酸の結晶はイオン結晶であり、水に溶けやすく融点が高いという特徴がある。
双性イオンと溶液のpH
- 双性イオンであるアミノ酸は、酸や塩基と反応することがある。
双性イオンと酸
酸と反応 → 陽イオンになる
- アミノ酸は結晶中で双性イオンとして存在している。
- これを水に溶かし、そこに酸(HClなど)を加えると次のように反応しアミノ酸は(双性イオンから)陽イオンとなる。
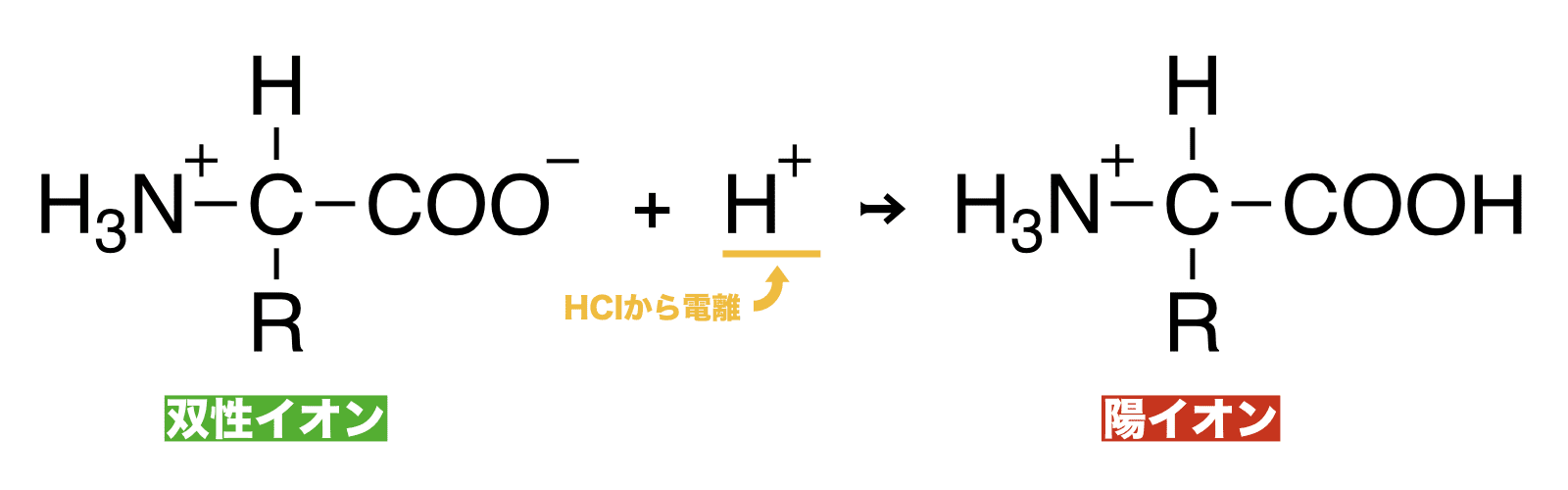
双性イオンと塩基
塩基と反応 → 陰イオンになる
- アミノ酸の結晶を水に溶かし、そこに塩基(NaOHなど)を加えるとアミノ酸は陰イオンとなる。
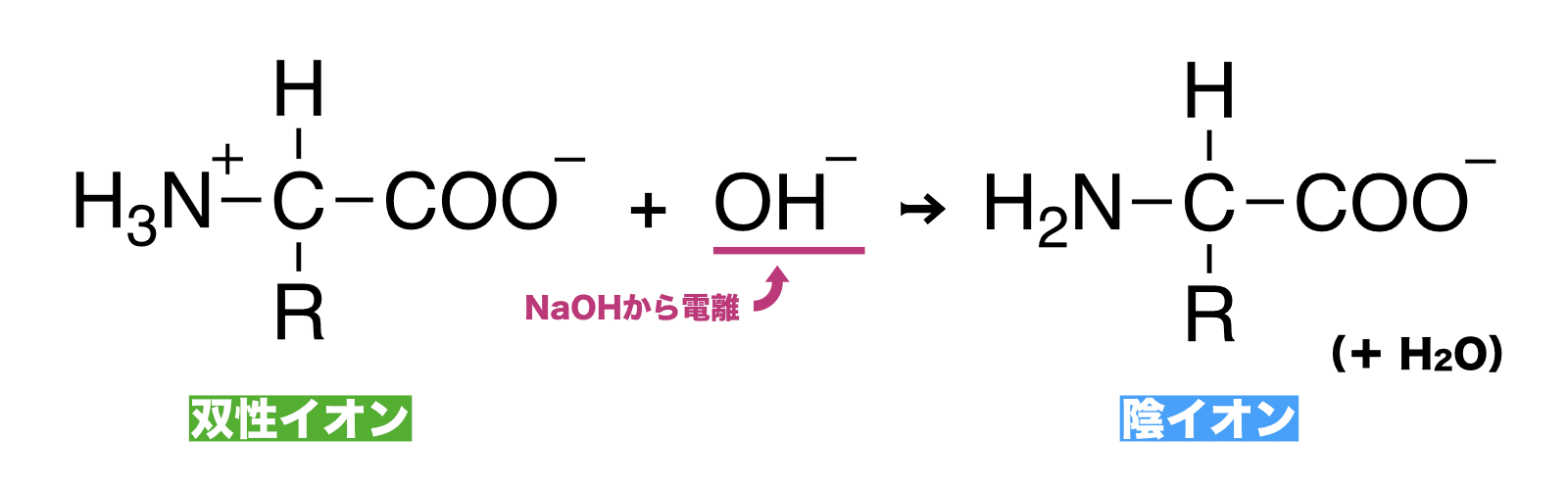
双性イオンの反応まとめ
- 最後に、双性イオンと酸・塩基の反応をまとめる。
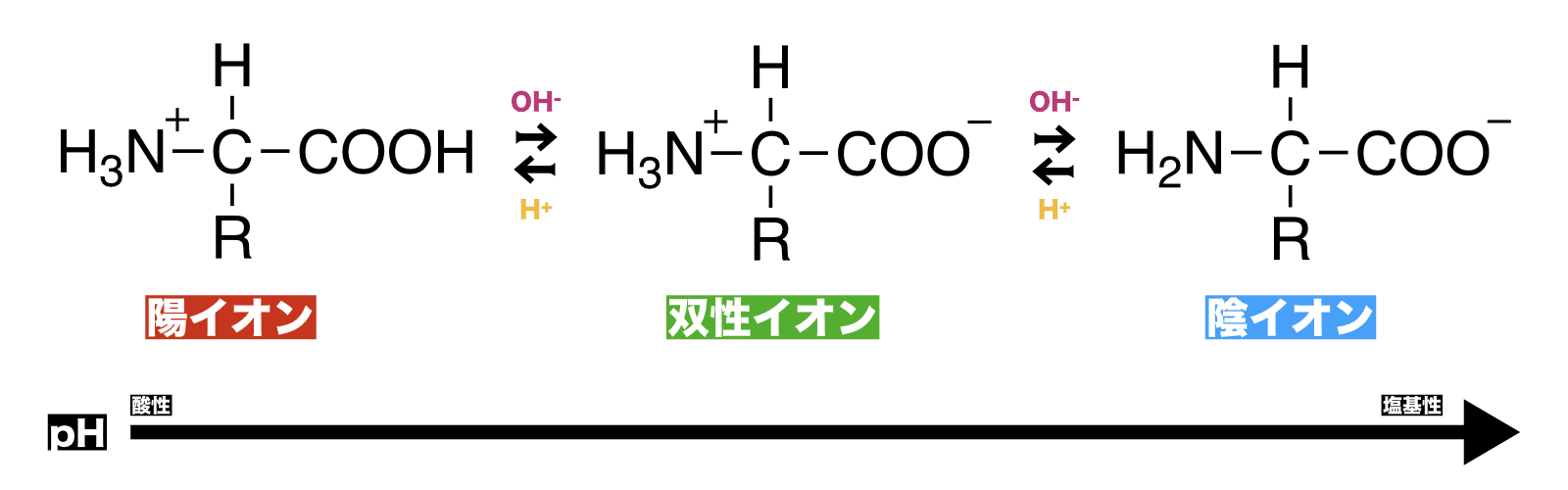
- アミノ酸は溶液のpHが下がる(酸性になる)ほど陽イオンの、pHが上がる(塩基性になる)ほど陰イオンの割合が高くなる。














