MENU
鉛蓄電池(仕組み・反応式・充電・計算問題の解き方など)
はじめに
【プロ講師解説】このページでは『鉛蓄電池(仕組み・反応式・充電・計算問題の解き方など)』について解説しています。
鉛蓄電池とは
- 鉛Pbと酸化鉛(Ⅳ)PbO2を希硫酸H2SO4に浸してできる電池を鉛蓄電池という。
- 鉛蓄電池の起電力は約2.1Vである。
鉛蓄電池の電池式
- 先述の通り、鉛蓄電池とは、鉛Pbと酸化鉛(Ⅳ)PbO2を希硫酸H2SO4に浸してできる電池である。
- これを踏まえて、鉛蓄電池の電池式は次のように表すことができる。
\[ \mathrm{(-)Pb|H_{2}SO_{4}aq|PbO_{2}(+) }\]
鉛蓄電池の仕組み
- 鉛蓄電池の仕組みについて、正極と負極に分けて解説する。
負極
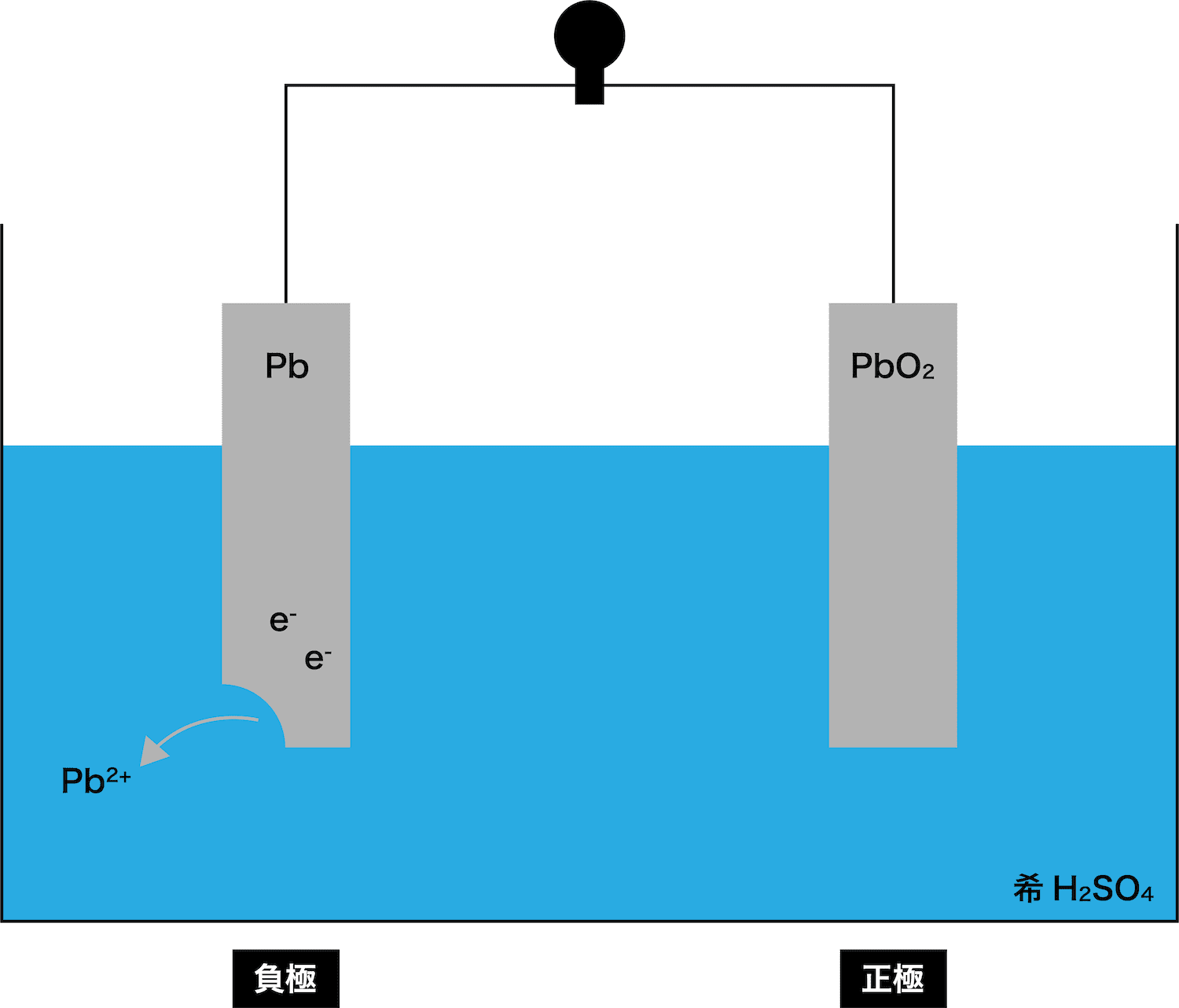
- 電池の仕組み(イオン化傾向との関わり・正極と負極・電子と電流の向き)でやったように、先に溶け出して自身がイオンとなり、電子eーを放出する金属板を負極という。
- 今回登場する2つの金属板PbとPbO2では、どちらが先に溶け出すのか、つまり負極となるのかを考える。
- PbとPbO2に含まれる鉛イオンは、それぞれPb2+とPb4+である。
Pb→Pb2+
PbO2→Pb4+
- Pb2+とPb4+は同じ「鉛」がイオンとなったものではあるが、その「安定性」に少し差がある。
【安定性】Pb2+>Pb4+
- Pb2+とPb4+の安定性を比べると、Pb2+の方がより安定である。
- したがって、(イオンがより安定な方が溶けてイオンになりやすいので)鉛蓄電池で先に溶け出す極板、つまり負極は「Pb板」ということになる。
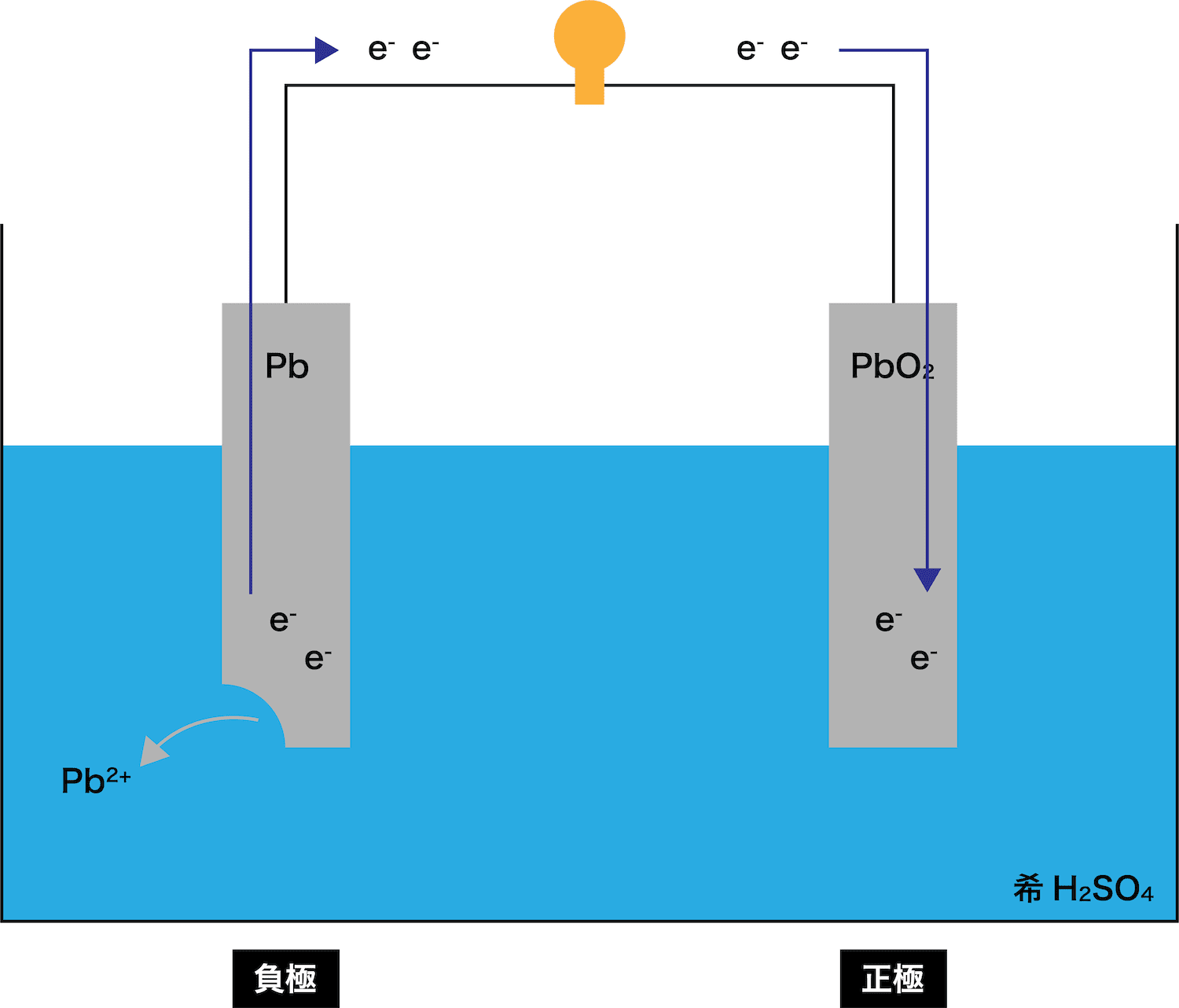
- ここからは、次の3STEPにしたがって負極における反応の流れを解説する。
●STEP1
Pb板が溶ける(Pb → Pb2+ + 2eー)
●STEP2
電子eーがPbO2板の方へと移動する
●STEP3
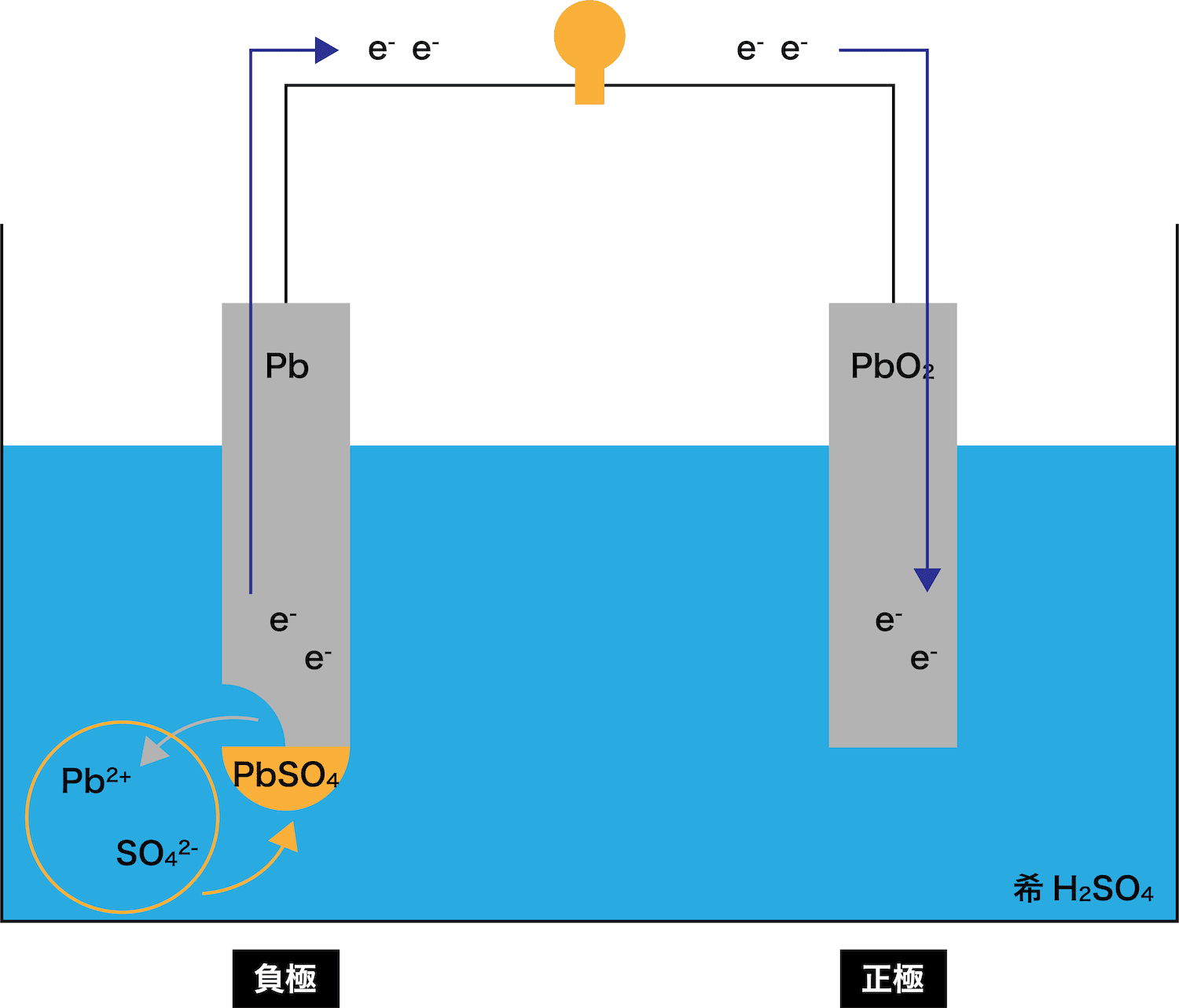
STEP1で発生したPb2+は溶液中のSO42ーとくっつく
→ PbSO4ができる
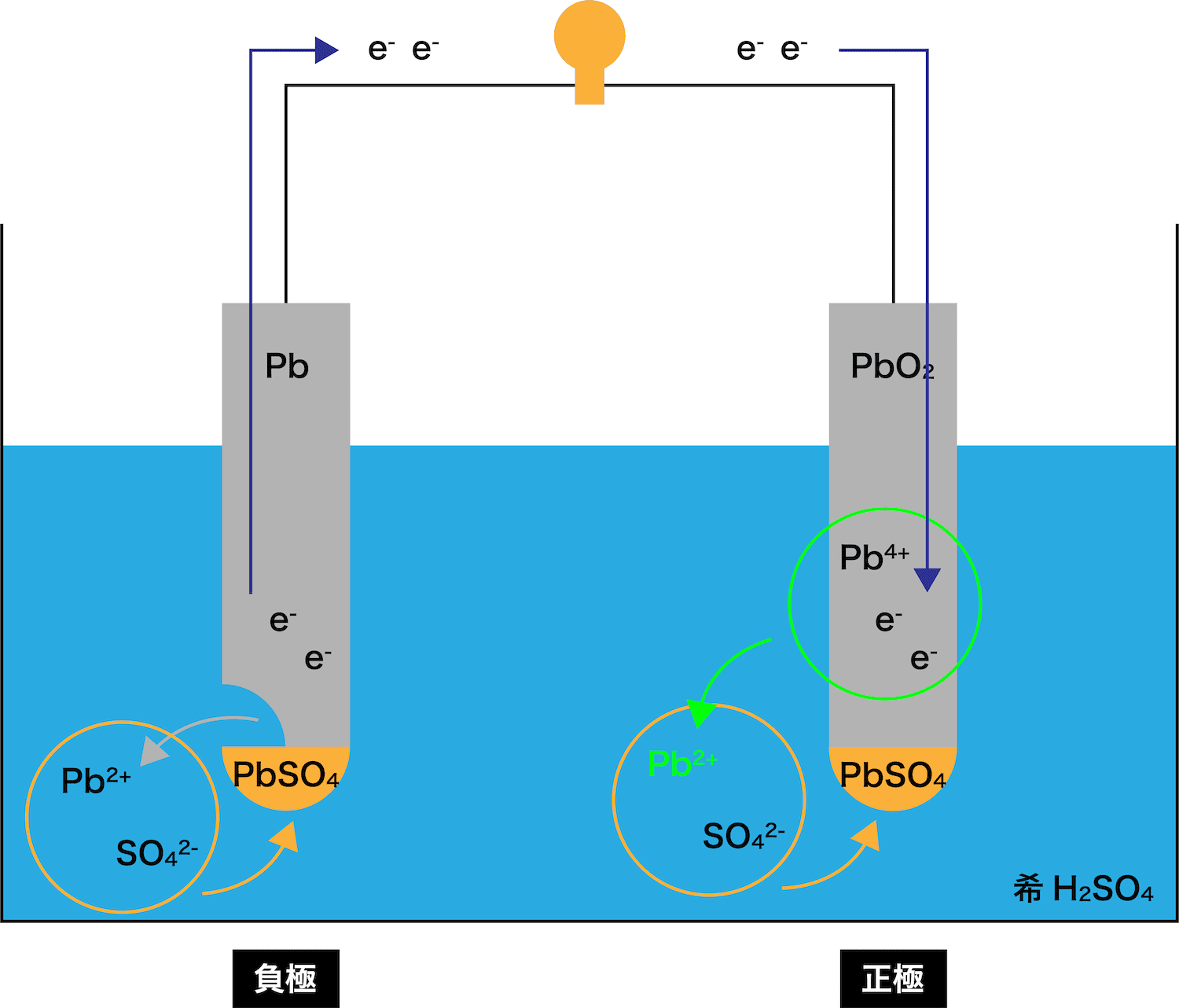
まず、イオン化傾向の大きいPb板が溶け出す。
STEP1でPb板が溶け出すことによって発生したeーが、正極であるPbO2板の方へと移動する。
→ PbSO4ができる
STEP1で発生したPb2+は、希H2SO4水溶液中の硫酸イオンSO42ーとくっつき「PbSO4」が生成する。
正極
- 電池の仕組み(イオン化傾向との関わり・正極と負極・電子と電流の向き)でやったように、負極から流れてきたeーを受け取る金属板を正極という。
- 鉛蓄電池における正極の反応について、次の2STEPにしたがって解説する。
●STEP1
負極から流れてきたeーをPbO2板が受け取る
→ Pb2+ができる
●STEP2
STEP1で発生したPb2+は溶液中のSO42ーとくっつく
→ PbSO4ができる
→ Pb2+ができる
Pb板から流れてきたeーがPbO2板まで到達すると、PbO2板を構成しているPb4+がこれを受け取る。
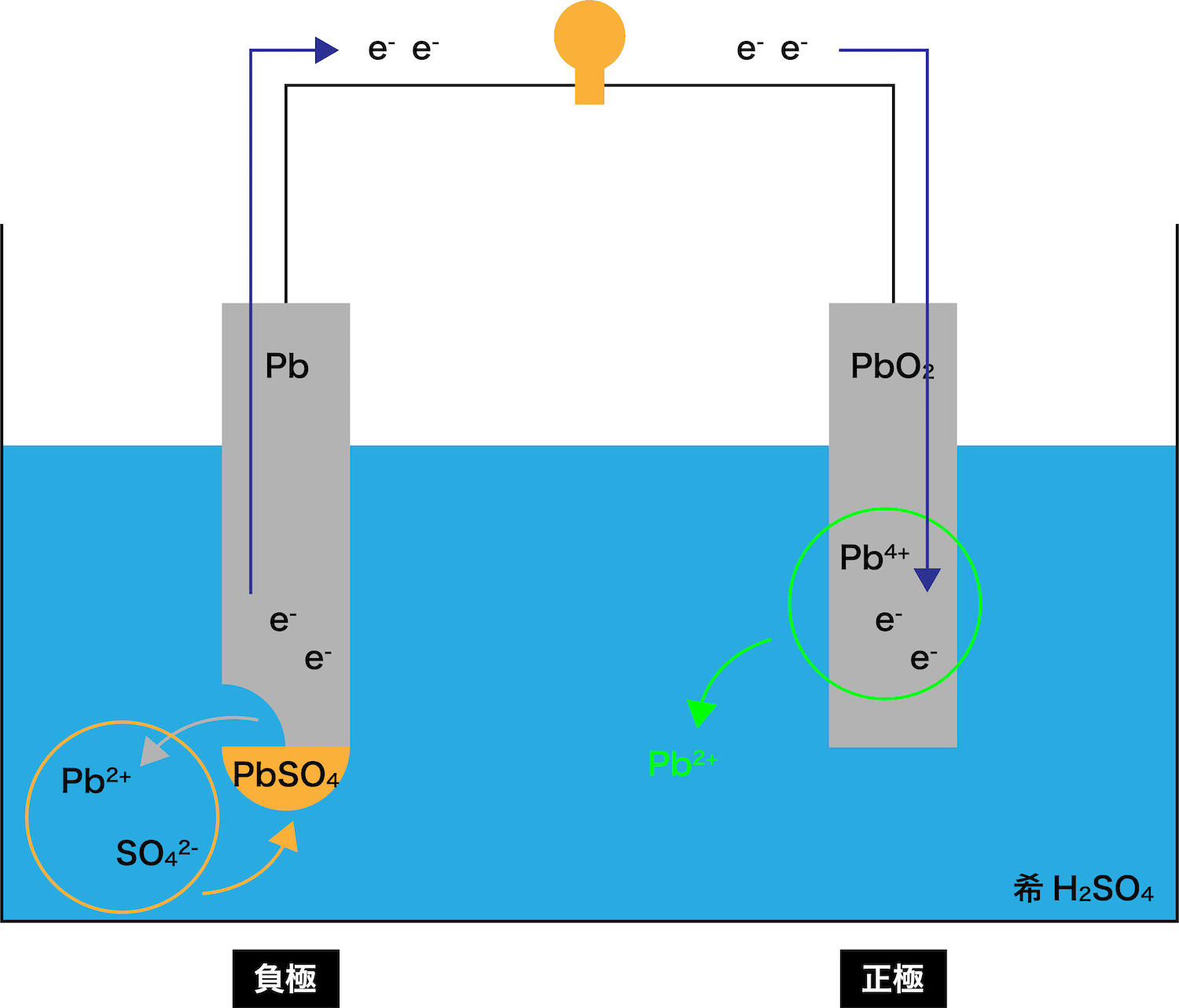
eーを受け取ったPb4+はPb2+となる。
→ PbSO4ができる
STEP1で発生したPb2+が、希H2SO4水溶液中の硫酸イオンSO42ーとくっつき「PbSO4」が生成する。

各極の反応
- 鉛蓄電池の負極・正極での反応をそれぞれまとめる。
負極
- 鉛蓄電池の負極では、Pb板が溶けてPb2+が発生する。
\[ \mathrm{Pb → Pb^{2+} + 2e^{-}} \]
- Pb2+は溶液中のSO42ーと反応するので、両辺にSO42ーを足すと…
\[ \mathrm{Pb + SO_{4}^{2-} → PbSO_{4} + 2e^{-}} \]
- これが、鉛蓄電池の負極の反応式である。
正極
- 鉛蓄電池の正極では、PbO2板が、負極から流れてきたeーを受け取る。
\[ \mathrm{PbO_{2} + 4H^{+} + 2e^{-} → Pb^{2+} + 2H_{2}O} \]
- 負極同様、Pb2+は溶液中のSO42ーと反応するため、両辺にSO42ーを足すと…
\[ \mathrm{PbO_{2} + 4H^{+} + SO_{4}^{2-} + 2e^{-} → PbSO_{4} + 2H_{2}O} \]
- これが、鉛蓄電池の正極の反応式である。
全体
- 最後に、負極・正極の反応式を使って、鉛蓄電池全体の反応式をつくる。
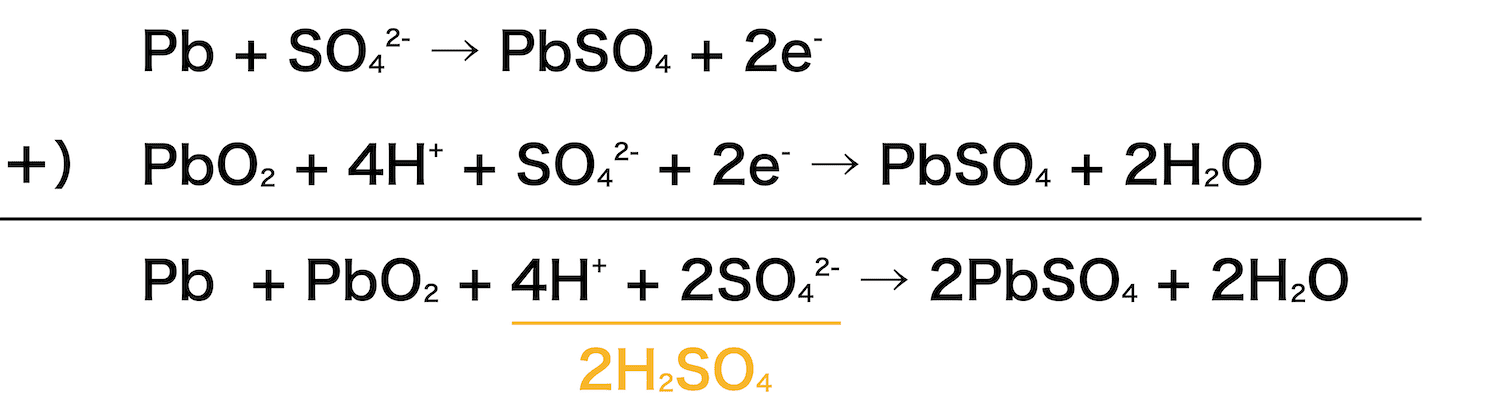
- 負極・正極の反応式と併せて覚えておこう。
鉛蓄電池は2次電池
- 電子を負極から正極に流して電流を発生させることを放電、それとは逆向きに電子を流すことを充電という。
- また、充電を行って繰り返し使用できる電池を二次電池、1回しか使うことができない電池を一次電池という。
- 鉛蓄電池は「二次電池」なので充電可能である。
鉛蓄電池の計算問題
- 鉛蓄電池に関する計算問題は入試でもよく出題される。基本的にワンパターンなので解き方を覚えてしまおう。
- 問題を解く前に、”前準備”として鉛蓄電池の「負極・正極における質量の変化」について確認する。
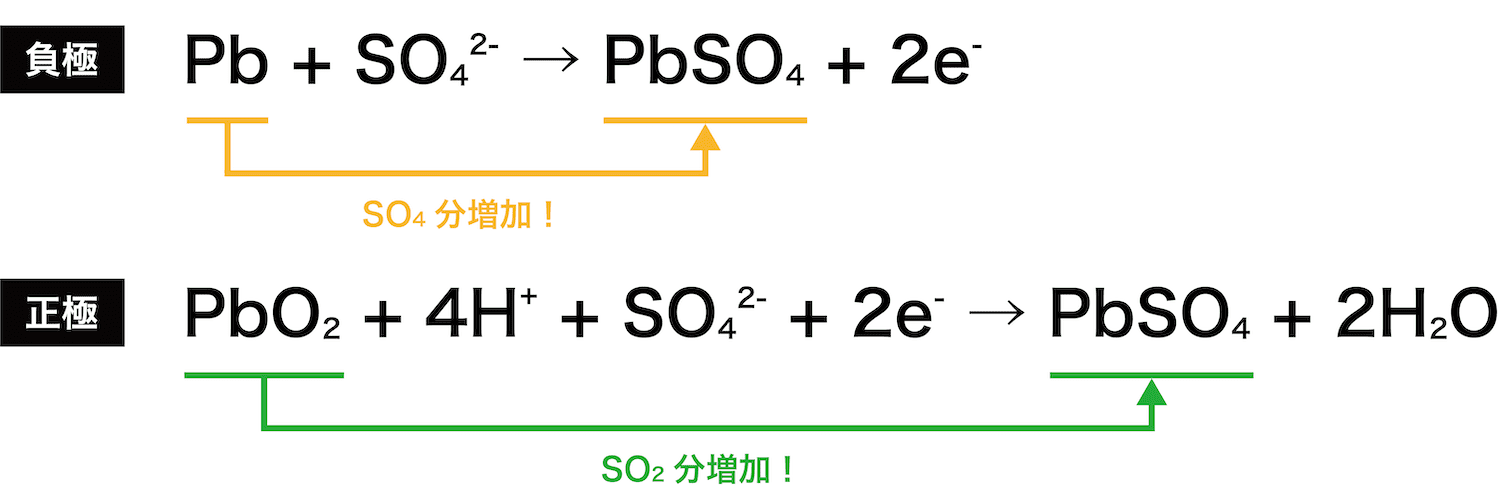
- 鉛蓄電池の負極・正極での反応式を見ると、負極では「SO4分」、正極では「SO2分」の質量が増加していることが分かる。したがって、(どちらの式もeーの係数が2なので)eー2molあたり、負極では96g、正極では64g、質量が増加する。
- このことを踏まえて、次の例題を解いてみよう。

鉛蓄電池を20秒間放電したところ、平均して2.0Aの電流が流れた。
このとき、次の問いに答えなさい。
ただし、電解液は30%の希H2SO4200ml(密度:1.25g/ml)とする。
(1)両極での反応を、eーを含むイオン反応式で書け。
(2)最初と比べて、放電後のPbO2の質量は何g増加したか。(有効数字2桁で解答、ファラデー定数F=9.65×104(C/mol))
(3)この鉛蓄電池を充電する場合、外部電源の負極はPbとPbO2のどちらにつなげば良いか。
(1)
負極
\[ \mathrm{Pb + SO_{4}^{2-} → PbSO_{4} + 2e^{-}} \]
正極
\[ \mathrm{PbO_{2} + 4H^{+} + SO_{4}^{2-} + 2e^{-} → PbSO_{4} + 2H_{2}O} \]
(2)
- まずは、電子eーのmolを求める。
\[ \begin{align} \mathrm{e^{-}(mol)}&=\mathrm{\frac{ 2.0(A)×20(秒) }{ 9.65×10^{4}(C/mol) }}\\
&\mathrm{≒4.15×10^{-4}}\end{align} \]
- 前準備として説明したように、反応の前後で正極の質量を比較すると、次のようになる。

- これは、電子が2molのときの話なので、今回の数値で求めていく。
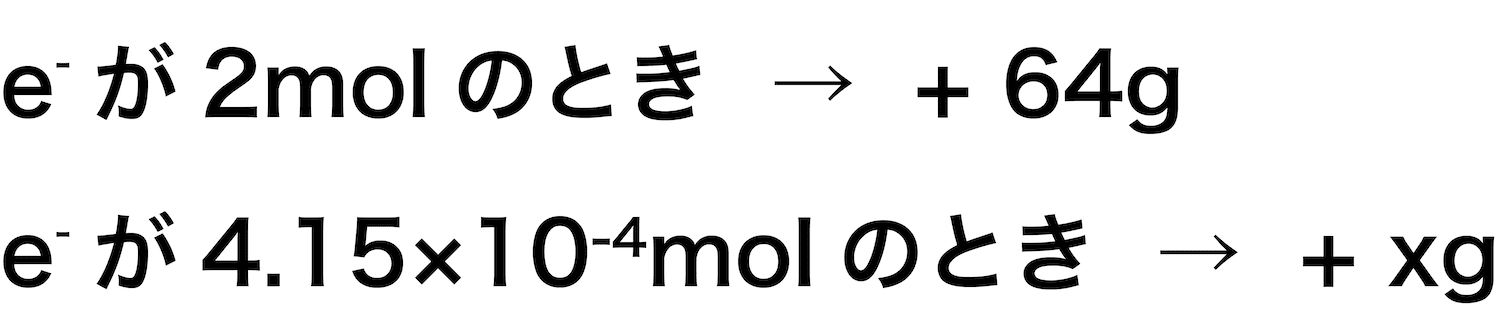
- 比を用いてxを求めると、次のようになる。
\[ 2:64=4.15×10^{-4}:x \\
\leftrightarrow x≒1.3×10^{-2}(g) \]
(3)
- 充電するときは、外部電源の負極は電池の負極に、正極は正極につなぐ。














