MENU
メタンハイドレートに関する計算問題の解き方
はじめに
【プロ講師解説】このページでは『メタンハイドレートに関する計算問題の解き方』について解説しています。
メタンハイドレートに関する計算問題の解き方
メタンハイドレートは、天然ガスのメタン分子が低温、高圧の一定条件下で水分子のつくるかご状構造の中に取り込まれたもので、外見は氷やドライアイスに似た固体である。メタンと水の組成比はメタン:水=4:23で、固体の密度は0.91(g/cm3)である。
(1)メタンハイドレートの化学式を4CH4・23H2Oとすると、式量はいくらか。
(2)メタンハイドレート1.0m3から得られるメタンガスの標準状態における体積は何m3か。
(3)メタンハイドレート1.0m3をある体積の容器に入れ、十分な酸素で満たして完全燃焼させた。燃焼後に容器内に存在する水の物質量は何molか。
『金沢工業大学 2013年 参考』
解答・解説(1)
解答:478
メタンハイドレートの化学式は問題文に書かれている通り4CH4・23H2Oである。
式量を求めるには、メタンハイドレートを構成してる原子(分子)の原子量(分子量)を足せばいいので、CH4の分子量が16、H2Oの分子量であることを考慮すると…
\[ 4×16 + 23×18 = 478 \]
答えは、478となる。
解答・解説(2)
解答:1.7×102m3
Lとcm3、Lの関係を確認しておこう。
1m3=1×106cm3=1×103L
この関係を頭に入れた上で、まずはメタンハイドレート1.0m3の物質量を求める。
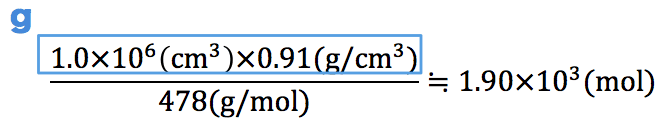
単位が最終的に「mol」になるように掛けたり割ったりする。メタンハイドレートの体積1.0m3を(0.91(g/cm3)と掛けて約分できるように)1×106cm3に変換していることに注意しよう。
次に、1分子のメタンハイドレートに含まれるメタンCH4分子の数は「4個」であることを考慮してCH4の体積を求めていく。
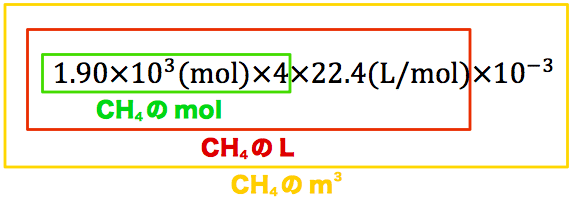
メタンハイドレートのmolに4をかけてメタンのmolを、メタンのmolに標準状態の気体の体積である22.4(L/mol)を掛けてメタンのLを、メタンのLに10-3を掛けて(1m3=1×103Lの関係を利用して)メタンのm3を求めている。
解答・解説(3)
解答:5.9×104mol
燃焼後に容器内に存在する水H2Oには2種類存在する。
- メタンハイドレート1m3中に始めから存在するH2O
- メタンハイドレート中のメタンCH4が燃焼することで生成するH2O
まず、メタンハイドレート1m3中に始めから存在するH2Oのmolを求めよう。
\[ \mathrm{1.90×10^{3}(mol)×23=4.37×10^{4}(mol)} \]
メタンハイドレート1分子にH2Oが23個含まれている(4CH4・23H2O)から、メタンハイドレートのmolに23をかけている。
次に、メタンハイドレート中のメタンCH4が燃焼することで生成するH2Oのmolを求めていく。
メタンの燃焼を表す反応式は次の通り。
\[ \mathrm{CH_{4}+O_{2}→CO_{2}+2H_{2}O} \]
1molのメタンから2molの水が出ているのがわかる。これを使って、次の式を作ることができる。
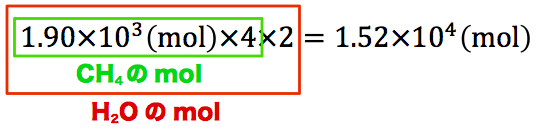
メタンハイドレートのmolに4をかけることでCH4のmolを、CH4のmolに2をかけることでH2Oのmolを出すことができる。
最後に、メタンハイドレート1m3中に始めから存在するH2Oのmolと、メタンハイドレート中のメタンCH4が燃焼することで生成するH2Oのmolを足して…
\[ \mathrm{4.37×10^{ 4 } + 1.52×10^{ 4 } ≒ 5.9×10^{ 4 }(mol)} \]














