MENU
固体の溶解度(温度との関係・計算問題・溶解度曲線など)
はじめに
【プロ講師解説】このページでは『固体の溶解度(温度との関係・計算問題・溶解度曲線など)』について解説しています。
溶解度とは
- ここに、100gの水を入れた容器があるとする。

- この容器に、少しずつ水酸化ナトリウム(固体)を加えていく。
- すると、一定量入れた所で水酸化ナトリウムが溶けず、固体のまま残るようになる。

- このように、物質にはそれぞれ100gの水に溶けることのできる限界の量(=固体の溶け残りが発生しないギリギリの量)が決まっており、その量を溶解度という。
- 溶解度まで溶質を溶かした溶液を飽和溶液ということも併せて覚えておこう。
溶解度曲線
- 固体の溶解度は、温度に依存して変化する。(基本的に温度が高くなるほどよく溶けるようになる)
- 温度による溶解度の変化をグラフで表したものを溶解度曲線という。
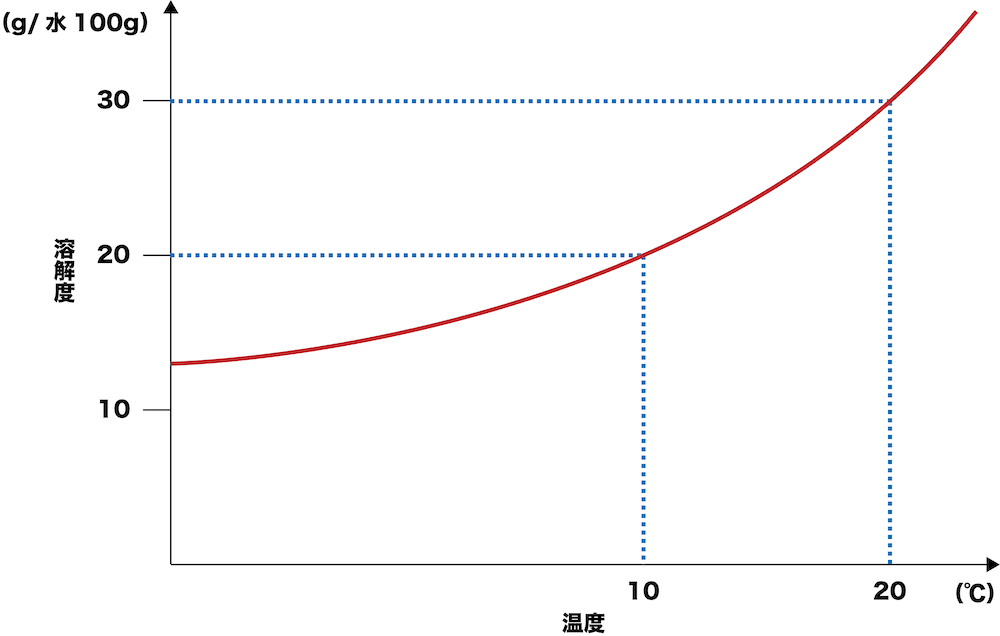
- この溶解度曲線の見方としては、10℃だと100gの水に20g溶ける(溶解度20)、20℃だと100gの水に30g溶ける(溶解度30)という感じである。温度が大きくなるほど溶解度が大きくなっているのが確認できる。
溶解度曲線と再結晶
- 先ほどの溶解度曲線をもう一度確認する。

- このグラフで、20℃において飽和状態にある溶液(つまり20℃で溶けることのできるMAXである30gが溶けている溶液)を10℃まで冷却したとする。
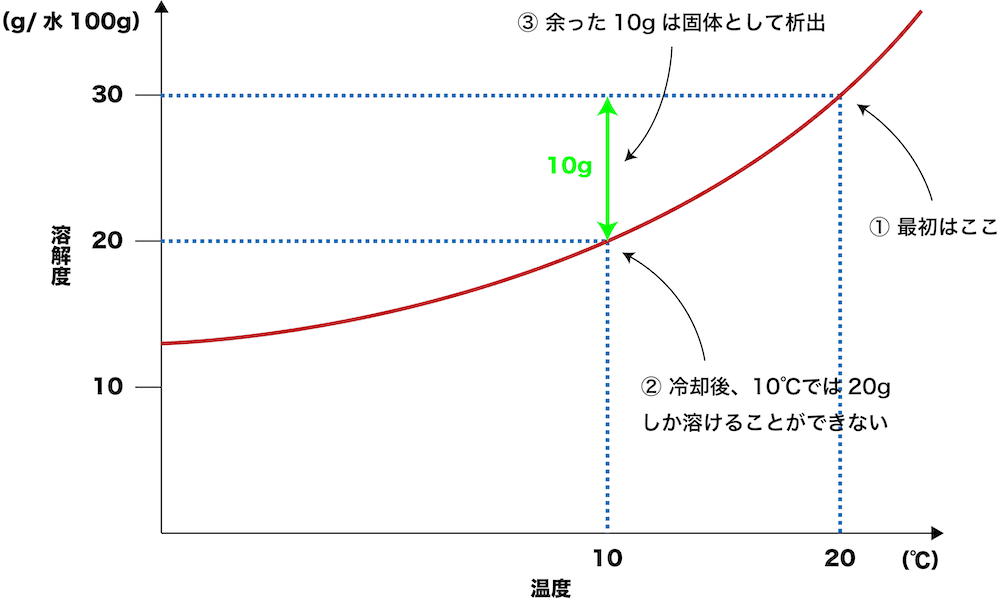
- 0℃での溶解度(溶けることができるギリギリの量)は20gなので、20℃で溶けていた30gの溶質のうち、10gは固体として析出する。
- このように、一度溶かした溶質を冷却によって再び固体として析出させることを再結晶という。
固体の溶解度計算
- 固体の溶解度計算について、大学入試で頻出の数パターンを解説する。
【パターン1】最も基本的な問題
20℃における硝酸カリウムの溶解度は30(g/水100g)である。次の問いに答えよ。
(1)20℃で100gの水に硝酸カリウムを20g溶かした。この溶液にはあと何gの硝酸カリウムを溶かすことができるか。
(2)20℃で水150gに溶かすことのできる硝酸カリウムは最大で何gか。
(3)20℃で100gの硝酸カリウム飽和水溶液に溶けている硝酸カリウムは何gか。
(1)
- 問題文に「20℃における硝酸カリウムの溶解度は30(g/水100g)である」と書いてあるため、今既に溶けているのが20gで、あと何g溶かせるのか求めたいのであれば、30から20を引けば良い。
\[ 30-20=10 \]
- よって、答えは10(g)である。
(2)
- 水100gに溶ける最大の量が溶解度である。したがって、水150gに溶ける量が知りたければ「比」の関係を使えばOK。
\[ \begin{align}&100:30 = 150:x\\
&\leftrightarrow x=45\end{align} \]
- よって、答えは45(g)である。
(3)
- 今度は”溶液(水と硝酸カリウムを合わせたもの)”の量しかわかっていないため、これを使って比の式をつくる。
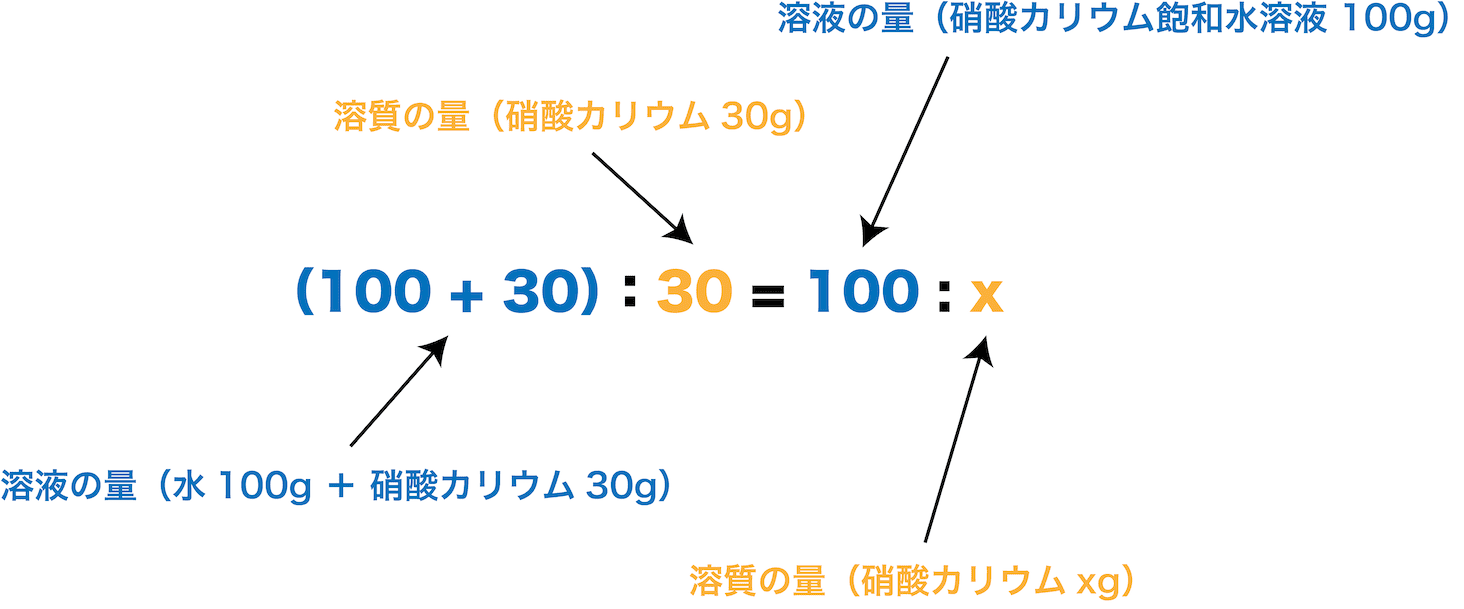
- 繰り返すが、20℃における硝酸カリウムの溶解度は30だから、水100gに硝酸カリウムはMAXで30g溶ける。したがって、この場合の「溶液:溶質」を考えると「(100+30):30」となる。
- また、今回の問題では溶液の量が100gと書いてあるので、そこに溶けている硝酸カリウムの量をxgとすると「溶液:溶質」は「100:x」となる。
- 温度が一定であれば(溶解度は変わらないので)「溶液:溶質」の比は一定のはずなので、「(100+30):30」と「100:x」をイコールで結んで解く。
\[ \begin{align}&(100+30):30 = 100:x\\
&\leftrightarrow x≒23\end{align} \]
- よって、答えは23(g)である。
【パターン2】蒸発を絡めて析出量を算出する問題
80℃において水100gに硝酸カリウム60gを溶かした。次の問に答えよ。ただし、硝酸カリウムの溶解度は20℃で30、40℃で60、80℃で160とする。
(1)この溶液を徐々に冷却していくと、結晶が析出し始めた。このときの温度はいくつか。
(2)この溶液を40℃に保った状態で、水を25g蒸発させた。このとき析出した硝酸カリウムは何gか。
(1)
- 硝酸カリウムが析出し始めるということは、その温度で溶液が飽和状態になるということである。
- したがって、「水100gに硝酸カリウム60gを溶かしてつくられた溶液」から硝酸カリウムが析出し始めるのは(問題で与えられている溶解度より)40℃である。
(2)
- 飽和溶液から温度一定で水を蒸発させると、蒸発した水に含まれていた分の硝酸カリウムがそのまま析出する。
\[ \begin{align}
\underbrace{ 溶媒 }
_{ \text{ (蒸発水) }}
:
\underbrace{ 溶質 }
_{ \text{ (析出量) }}
&=100:60\\
&=25:x
\end{align} \]
- これを解くと、答えは15(g)である。
【パターン3】冷却で生じる析出量を求める問題
80℃の硝酸カリウム飽和水溶液100gを20℃まで冷却したときに析出する結晶(硝酸カリウム)は何gか。ただし、硝酸カリウムの溶解度は20℃で30、80℃で160とする。
- このように飽和水溶液を冷却する問題では、与えられている溶解度を用いて「仮の飽和水溶液」をつくり、それを冷却することで得られる析出量を元に計算する。(ちょっと表現が難しいが下を読めばわかるはず)

- まずは「もし水100gに硝酸カリウムがMAXまで溶けた水溶液があったら」と考える。
問題文に硝酸カリウムの溶解度は80℃で160だと書いてあるので、左側の容器にその情報を書き込む。
これを20℃まで冷却すると(20℃での溶解度は30であり、30gしか溶けていられないため)もともと溶けていた160gの硝酸カリウムのうち(160-30)gは固体として析出する(黄色い所)。 - 次に、上で導き出した値を使って、聞かれている値を求めていく。
\[ \begin{align}
溶液:析出量&=(100+160):(160-30)\\
&=100:x
\end{align} \]
- 温度に関する条件が変わらなければ溶解度は変わらないので、溶液と析出量の比も変化しない。
- したがって、先ほど求めた溶液(160+100g)と析出量(160ー30g)の比「(160+100):(160ー30)」と、今回問題与えられている溶液と析出量の比「100:x(析出量は勝手にxとおいた)」をイコールで結んで、それを解けば良い。
- 式を解くと、答えは50(g)である。
【パターン4】水和物が析出する問題
(1)硫酸銅(Ⅱ)五水和物100g中に含まれる硫酸銅(Ⅱ)は何gか。
(2)80℃の硫酸銅(Ⅱ)飽和水溶液100gを20℃まで冷却すると、硫酸銅(Ⅱ)五水和物の結晶が析出した。この結晶の質量は何gか。ただし、硫酸銅(Ⅱ)の溶解度は20℃で20、80℃で56とする。
(1)
- 硫酸銅(Ⅱ)五水和物の化学式はCuSO4・5H2Oである。したがって、硫酸銅(Ⅱ)五水和物の式量は次のように求められる。
\[ \underbrace{
\underbrace{ \mathrm{CuSO_{4}} }
_{ \text{ 160 }}
・
\underbrace{ 5\mathrm{H_{2}O} }
_{ \text{ 90 }}
}
_{ \text{ 250 }} \]
- Cu,S,Oの原子量はそれぞれ64,32,16なのでCuSO4は160、H,Oの原子量はそれぞれ1,16なので5H2Oは90、これらを足しあわせるとCuSO4・5H2Oの式量は250となる。
- 硫酸銅(Ⅱ)五水和物100g中に含まれる硫酸銅(Ⅱ)の割合を求めるには、硫酸銅(Ⅱ)五水和物の質量である100gに硫酸銅(Ⅱ)五水和物中に含まれる硫酸銅(Ⅱ)の割合をかければOK。
\[ 100×\frac{ 160 }{ 250 }=64 \]
- よって、答えは64(g)である。
(2)
- 問題文より、硫酸銅(Ⅱ)の溶解度は80℃で56なので、80℃の飽和水溶液に含まれる硫酸銅(Ⅱ)の量は次のようになる。
\[ \begin{align} 溶液:溶質 &=(100+56):56 \\
&= 100:x \end{align} \]
- これを解くと、x≒36gとなる。
- 冷却後の硫酸銅(Ⅱ)の質量は、もともとあった36gから沈殿に含まれる硫酸銅(Ⅱ)分の質量を引いた値になる。
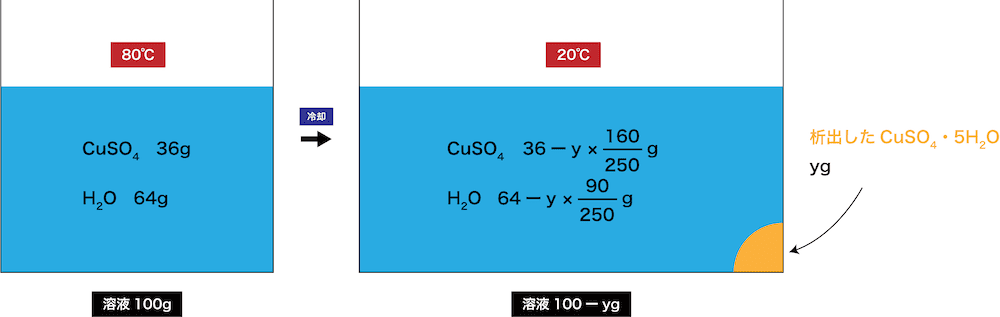
- 以上より、次のような式をたてることができる。
\[ \begin{align} 溶液:溶質 &=(100+20):20 \\
&= (100-y):(36-\frac{ 160 }{ 250 }y) \end{align} \]
- これを解くと、y≒41gとなる。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
物質にはそれぞれ100gの水に溶けることのできる限界の量が決まっており、その量を【1】という。
また、【1】まで溶質を溶かした溶液を【2】溶液という。
解答/解説:タップで表示
解答:【1】溶解度【2】飽和
物質にはそれぞれ100gの水に溶けることのできる限界の量(=固体の溶け残りが発生しないギリギリの量)が決まっており、その量を溶解度という。
溶解度まで溶質を溶かした溶液を飽和溶液という。
固体の溶解度は【1】に依存して変化する。【1】による溶解度の変化をグラフで表したものを【2】という。
解答/解説:タップで表示
解答:【1】温度【2】溶解度曲線
固体の溶解度は、温度に依存して変化する。(基本的に温度が高くなるほどよく溶けるようになる)
温度による溶解度の変化をグラフで表したものを溶解度曲線という。

物質が溶解している水溶液の条件(主に温度)に変化を加え、目的の物質を固体として析出する操作を【1】という。














