MENU
溶液・溶解【高校化学・化学基礎一問一答】
水などの液体に固体が溶けることを【1】という。
解答/解説:タップで表示
固体が液体になることを【1】という。
解答/解説:タップで表示
【1】は溶けている物質、【2】は溶質を溶かしている液体、【3】は溶媒と溶質を合わせたものである。
解答/解説:タップで表示
塩化ナトリウムのように水溶液中で電離する物質を【1】、糖類のように電離しない物質を【2】という。
解答/解説:タップで表示
解答:【1】電解質【2】非電解質
塩化ナトリウムのように水溶液中で電離する物質を電解質、糖類のように電離しない物質を非電解質という。
水分子が溶質の分子やイオンと強く引き合うことを【1】という。
解答/解説:タップで表示
解答:【1】水和
水分子が溶質の分子やイオンと強く引き合うことを水和という。
水和しているイオンを【1】、水和している分子を【2】という。
解答/解説:タップで表示
解答:【1】水和イオン【2】水和分子
水和しているイオンを水和イオン、水和している分子を水和分子という。また、水和している陽イオンを水和陽イオン、水和している陰イオンを水和陰イオンとよぶこともある。
水分子は【1(極性or無極性)】分子であり、塩化ナトリウムNaClを入れると水H2O分子の水素H原子が【2】イオンを、酸素O原子が【3】イオンを取り囲み、いわゆる”溶けた”状態になる。
解答/解説:タップで表示
解答:【1】極性【2】塩化物イオン【3】ナトリウムイオンNa
NaClは水の中で次のように電離している。
\[ \mathrm{NaCl → Na^{+}+Cl^{-}} \]
電離により生じるナトリウムイオンNa+と塩化物イオンClーの周りには、それぞれ水分子のδー部分とδ+部分が近づいてくる。
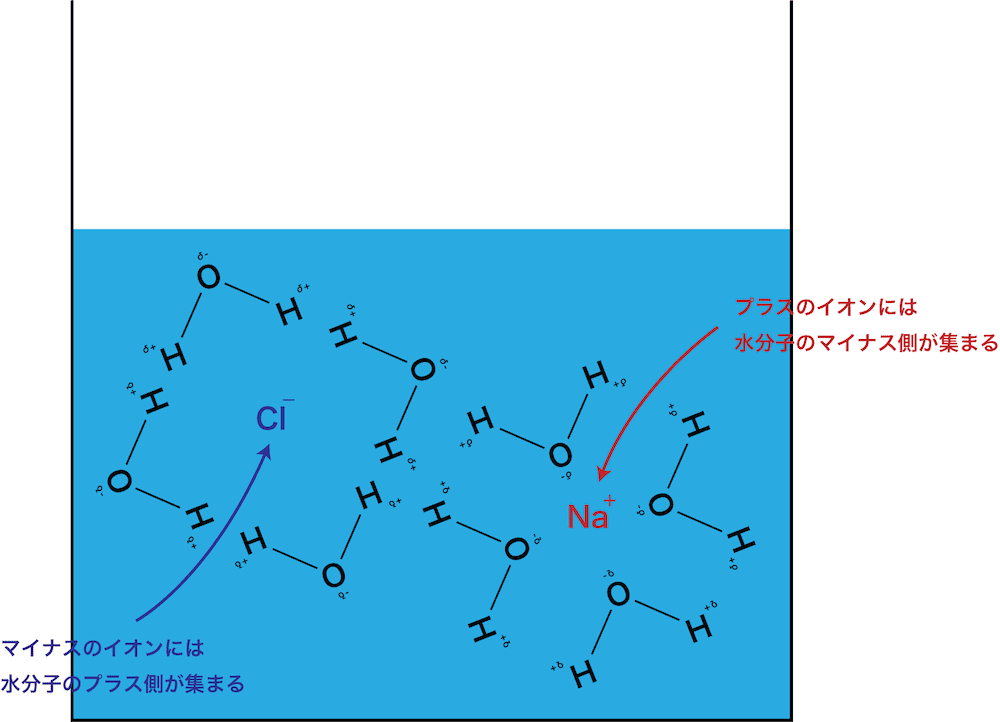
その結果、いわゆる”水和”した状態となり、ナトリウムイオンNa+とClーは引き離される。
水和水が分子にくっついたものを【1】といい、代表的な【1】である硫酸銅五水和物の化学式は【2】である。
解答/解説:タップで表示
解答:【1】水和物【2】CuSO4・5H2O
硫酸銅(Ⅱ)水溶液を冷却して得られる結晶は、CuSO4:H2O=1:5の物質量比からなる結晶で、この結晶を硫酸銅五水和物という。硫酸銅五水和物の化学式は次のようになる。
\[ \mathrm{CuSO_{4}・5H_{2}O} \]














