MENU
凝固点降下【高校化学・化学基礎一問一答】
問1
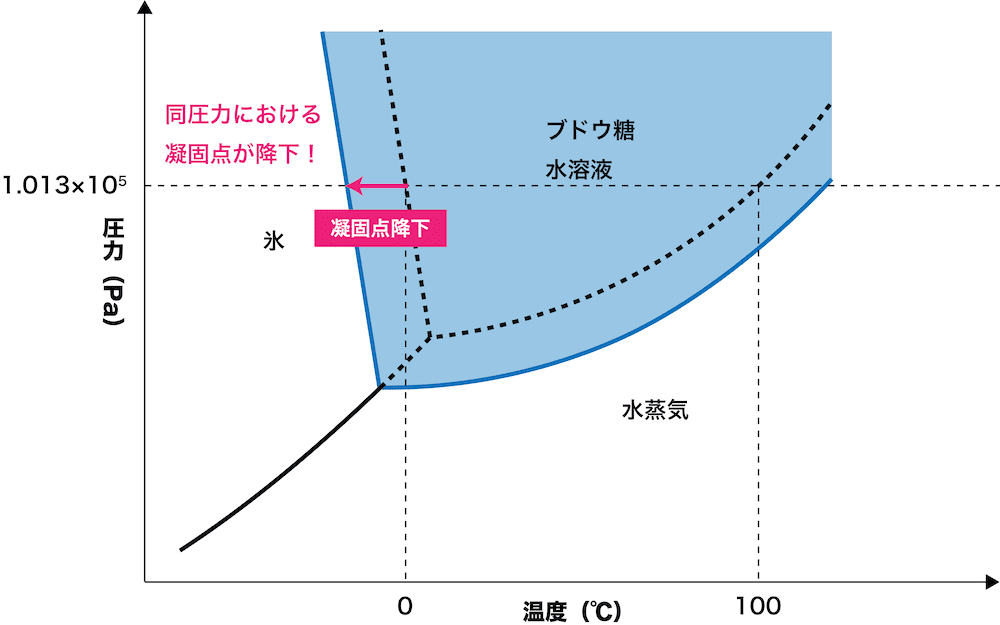
溶媒に不揮発性物質(=溶質)を溶かして溶液にすると、溶媒だけのときよりも凝固点が低下する。これを【1】という。
解答/解説:タップで表示
問2
モル凝固点降下は【1(溶質 or 溶媒)】の種類によって決まる。
解答/解説:タップで表示
解答:【1】溶媒
●凝固点降下の公式
ΔTf = Kf・m
ΔTf:凝固点降下度
Kf:モル凝固点降下(K・kg/mol)(定数:溶媒に固有)
m:質量モル濃度(mol/kg)
問3
1.11gの塩化カルシウムCaCl2を600gの水に溶かして塩化カルシウム水溶液を調製した。この溶液の凝固点は何℃か。ただし、水のモル凝固点降下は1.85(K・kg/mol)、各原子の原子量はCa=40、Cl=35.5とする。
解答/解説:タップで表示
解答:ー0.0925(℃)
凝固点降下の公式を用いて式をたてる。
\[ \begin{align} ΔT_{f} &= K_{f}・m \\
&= 1.85×\frac{ \frac{ 1.11\cancel{(\mathrm{g})} }{ 111(\cancel{\mathrm{g}}/\mathrm{mol}) }×3 }{ \frac{ 600 }{ 1000 }(\mathrm{kg}) } \\
&= 0.0925 \end{align} \]
よって、凝固点はー0.0925(℃)となる。
分子に3をかけているのは、CaCl2が電離した結果、CaCl21molがイオン3mol分(Ca2+が1mol、Clーが2mol)になるからである。
\[ \mathrm{CaCl_{2}→Ca^{2+}+2Cl^{-}} \]