MENU
ヘスの法則【高校化学・化学基礎一問一答】
「化学変化に伴う反応エンタルピーは、反応前後の状態で決まり、反応経路によって変化しない」これを【1】の法則という。
解答/解説:タップで表示
次に示す熱化学反応式を用いて、エチレンの燃焼エンタルピーを求めよ。
H2(気)+1/2O2(気)→H2O(液) ΔH=ー286kJ
C(固)+O2(気)→CO2(気) ΔH=ー394kJ
2C(固)+2H2(気)→C2H4(気) ΔH=+52KJ
解答/解説:タップで表示
解答:ー1412kJ
今回は「エチレンの燃焼熱」を求める問題のため、エチレンの燃焼反応を表す熱化学反応式を書く。
\[ \mathrm{C_{2}H_{4}(気)+3O_{2}(気)→2CO_{2}(気)+2H_{2}O(液)}~~~ΔH=Q\mathrm{kJ} \]
次に、STEP1でつくった熱化学反応式の中にある物質を与式から探す。
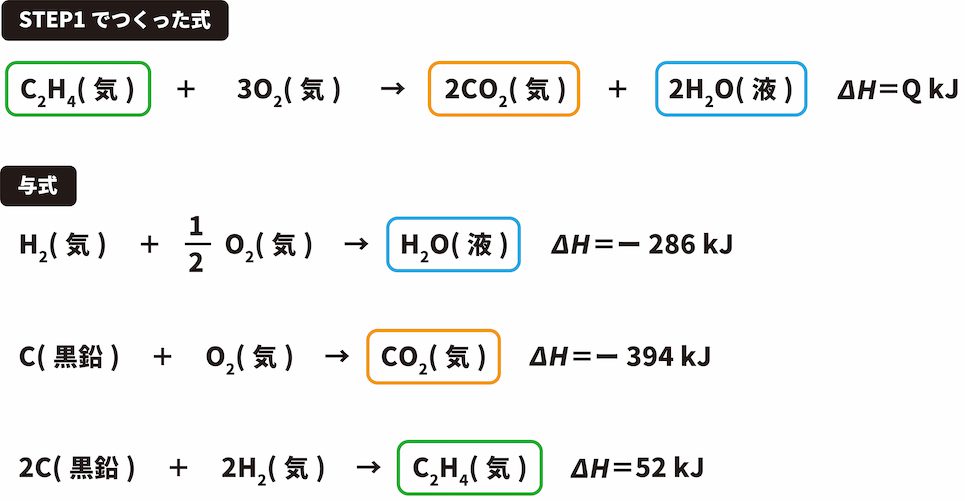
この解法を使うときは、STEP1でつくった式に含まれる物質のうち、2つ以上の与式に出てきている物質(今回の場合、C(黒鉛)、O2(気))は無視する。

CO2は両方の式で右側にあるため、与式の反応エンタルピーである「ー394kJ」をそのまま(ただし、つくった式でのCO2の係数は2のため2をかける)用いる。
C2H4はつくった式では左側にあるに対し、与式では右側にあるため、マイナス(ー)の符号をつけて「ー52kJ」となる。
H2Oは、両方の式で右側にあるため、CO2同様「ー286kJ」をそのまま用いる(ただし、つくった式でのH2Oの係数は2のため2をかける)。
これらの値を全て足し合わせると、求めたい反応エンタルピーを求めることができる。
メタンCH4の生成反応は次の熱化学反応式で表される。
C(黒鉛)+2H2(気)→CH4(気) ΔH=QkJ
以下の反応エンタルピーを用いてCH4の生成エンタルピーQを求めよ。
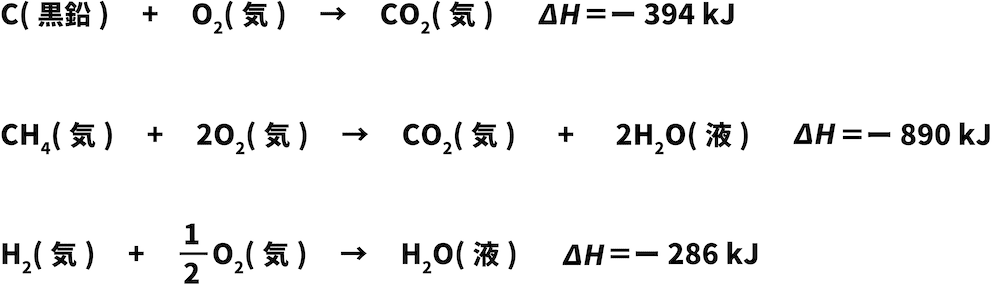
黒鉛の燃焼エンタルピー:ー394kJ/mol
メタンの燃焼エンタルピー:ー890kJ/mol
水素の燃焼エンタルピー:ー286kJ/mol
解答/解説:タップで表示
解答:ー76kJ
問題文より、反応エンタルピーに関する以下の情報が与えられている。
黒鉛の燃焼エンタルピー:ー394kJ/mol
メタンの燃焼エンタルピー:ー890kJ/mol
水素の燃焼エンタルピー:ー286kJ/mol
これらの反応エンタルピーを含む熱化学反応式を書く。
次に、与式の中にある物質をSTEP1でつくった熱化学反応式から探す。
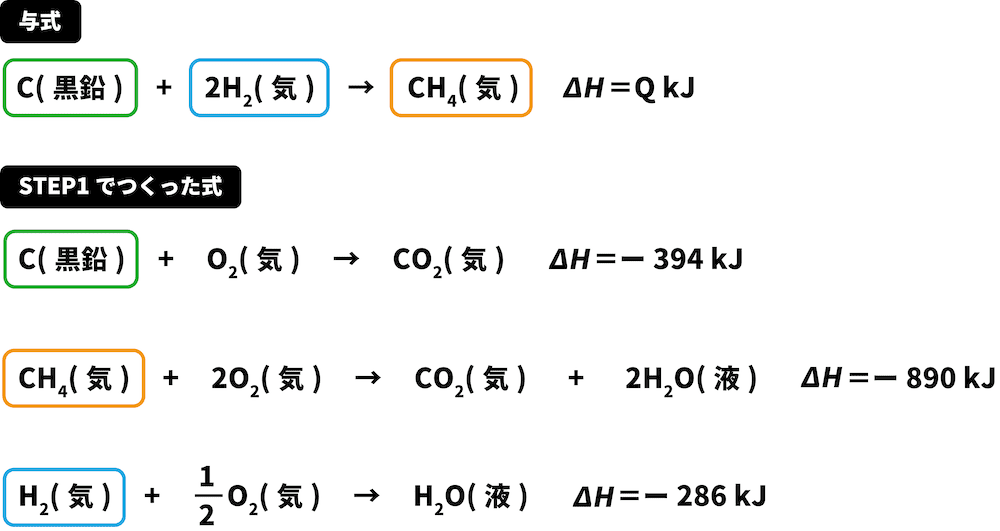
この解法を使うときは、2つ以上の式に出てきている物質(今回の場合、C(黒鉛)、O2(気))は無視する。
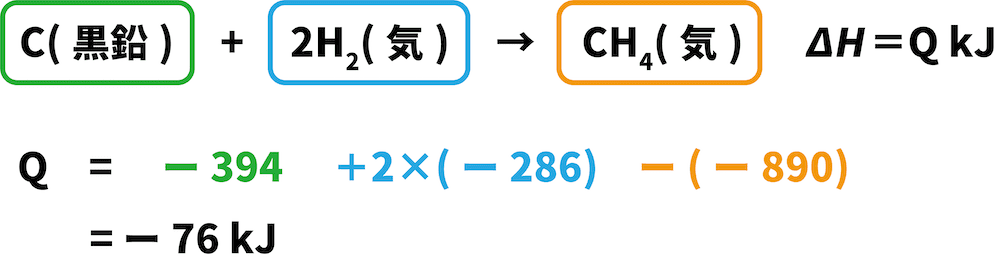
Cは両方の式で左側にあるため、与式の反応エンタルピーである「ー394kJ」をそのまま用いる。
H2は両方の式で左側にあるため、与式の反応エンタルピーである「ー286kJ」をそのまま用いる(ただし、つくった式でのH2の係数は2のため2をかける)。
CH4は与式では右側にあるに対し、つくった式では左側にあるため、マイナス(ー)の符号をつけて「ー(ー890)kJ」となる。
これらの値を全て足し合わせると、求めたい反応エンタルピーを求めることができる。














