MENU
化学平衡【高校化学・化学基礎一問一答】
問1
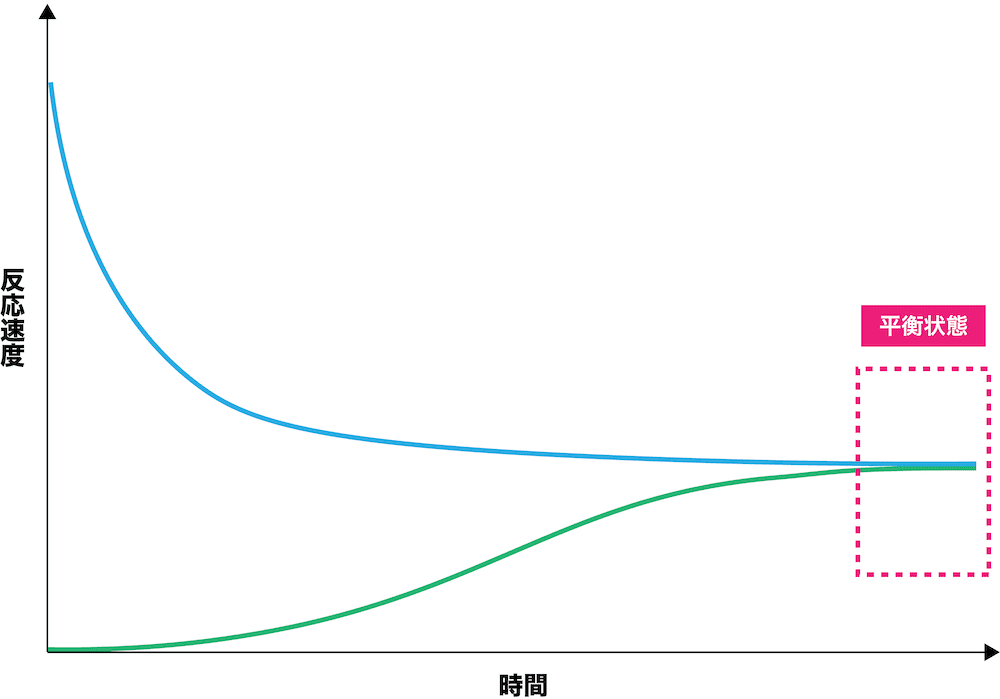
正反応の速度は次第に【1(大き or 小さ)】く、逆反応の速度は次第に【2(大き or 小さ)】くなっていくが、両方とも最終的には同じ速度に落ち着き一定となる。この、正反応と逆反応の速度が等しくなった状態を【3】という。
解答/解説:タップで表示
解答:【1】小さ【2】大き【3】平衡状態
正反応の速度は次第に小さく、逆反応の速度は次第に大きくなっていくが、両方とも最終的には同じ速度に落ち着き一定となる。
この正反応と逆反応の速度が等しくなった状態を平衡状態という。
問2
平衡状態になると一見反応が止まっているように見えるが、実際は【1】反応と【2】反応が起こっており、2つの速度が【3(等しい or 異なる)】ため反応が進んでないように見えるだけである。
解答/解説:タップで表示
解答:【1】正【2】逆【3】等しい(【1】・【2】は順不同)
平衡状態になると、一見反応が止まっているようにみえる。しかし実際は、「正反応と逆反応が起こっているが、2つの速度が等しいため反応が進んでないように見えるだけ」だということを把握しておこう。

問3
「H2 + I2 ⇆ 2HI」の反応において、反応前のH2とI2のmol数が1.0、平衡時は0.20だとすると、平衡時のHIの物質量は【1】molである。
解答/解説:タップで表示
解答:【1】1.6
反応前のH2とI2のmol数が1.0、平衡時は0.20だとすると、次のように考えることができる。

反応で使われたH2とI2は0.80mol(1.0ー0.20)ずつなので、係数比より生成したHIは1.6molであることがわかる。














