MENU
電気陰性度【高校化学・化学基礎一問一答】
問1
原子が共有電子対を自分の方に引っ張る強さを【1】という。
解答/解説:タップで表示
問2
電気陰性度は同一周期において、右にいくほど【1(大き or 小さ)】くなる傾向がある。
解答/解説:タップで表示
問3
電気陰性度は同族において、下にいくほど【1(大き or 小さ)】くなる傾向がある。
解答/解説:タップで表示
問4
周期表の左下にある元素は【1(陽 or 陰)】性が強い傾向がある。
解答/解説:タップで表示
問5
周期表の右上にある元素は【1(陽 or 陰)】性が強い傾向がある。
解答/解説:タップで表示
問6
電気陰性度の周期表上での傾向を表すグラフとして適切なのはどれか。
①
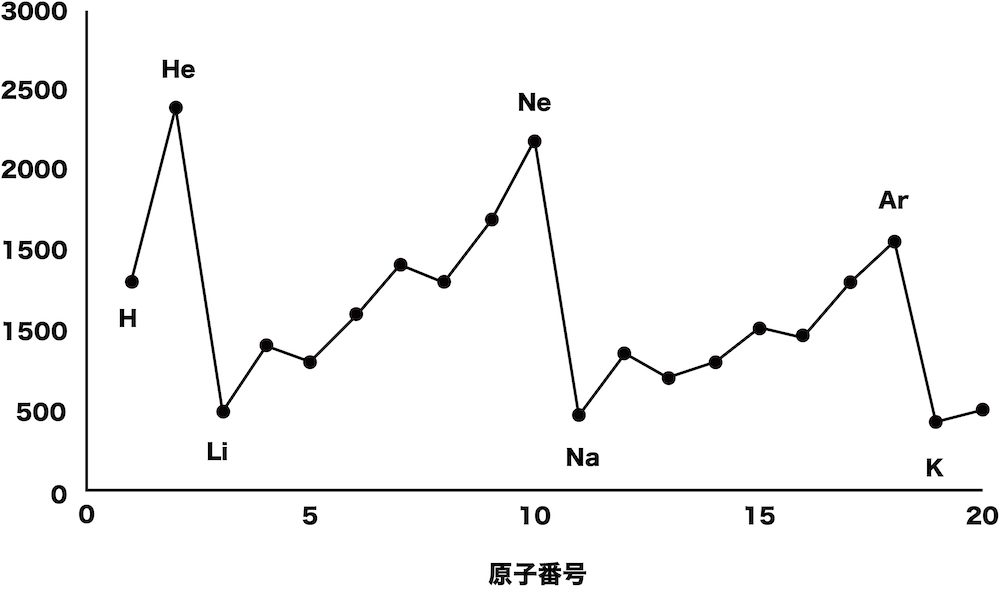
②
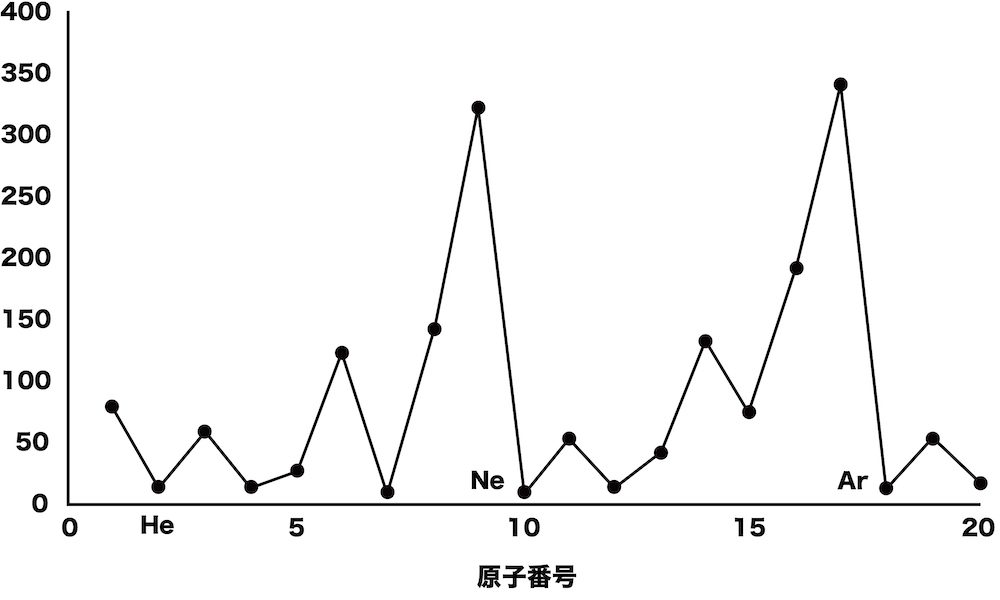
③
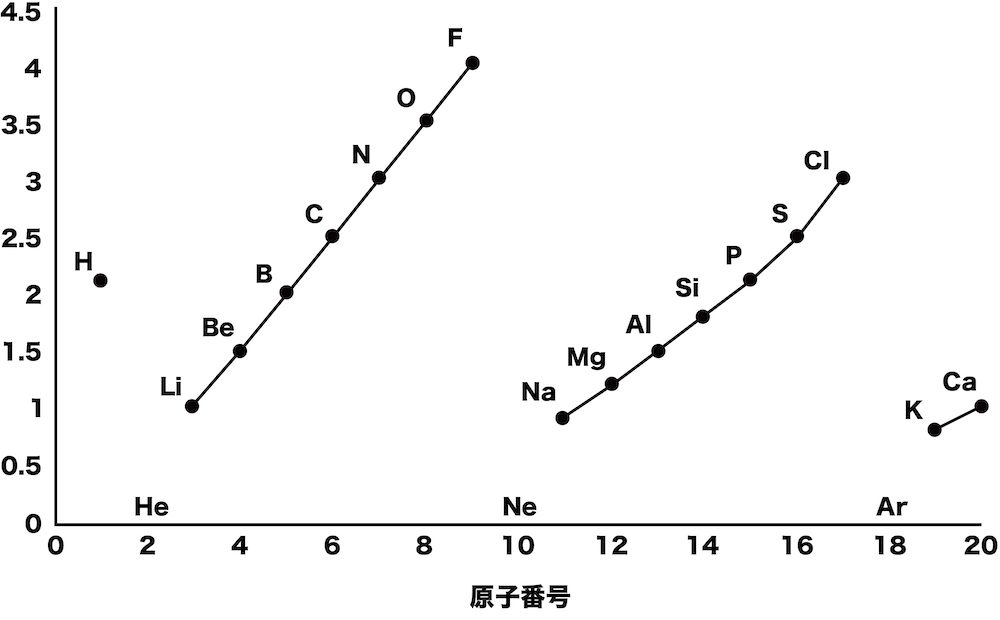
解答/解説:タップで表示
解答:③
①はイオン化エネルギー、②は電子親和力、③は電気陰性度を表したグラフである。
参考:イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)
参考:電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など)
参考:電気陰性度(表・覚え方・一覧・電子親和力との関係など)














