MENU
溶解度積【高校化学・化学基礎一問一答】
問1
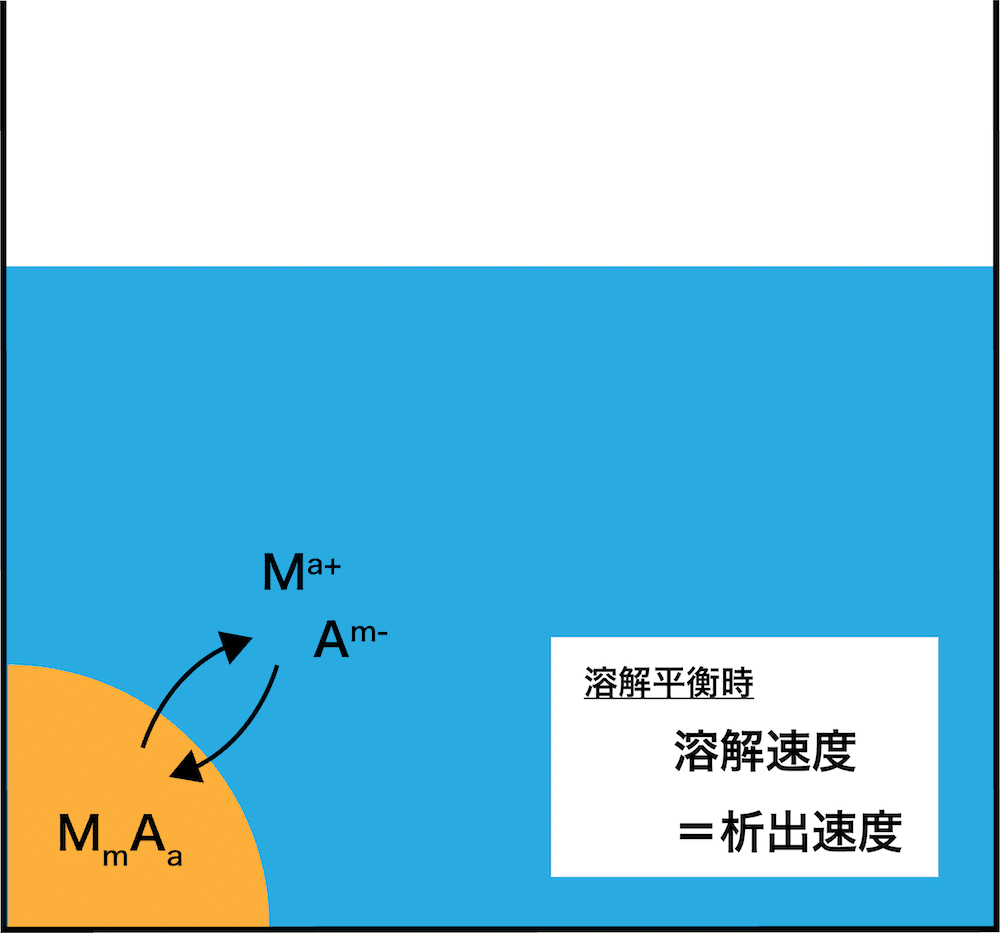
飽和溶液において、沈殿の一部が溶解し平衡状態になることを【1】という。
解答/解説:タップで表示
問2
塩化銀AgClを水に溶解させると、一部のAgClが溶け残った水溶液ができ、溶解平衡の状態に達した。この溶解平衡の平衡定数K(AgCl)は次のように表される。
\(K(\mathrm{AgCl}) = \frac{\mathrm{[【1】]}\mathrm{[【2】]}}{ [\mathrm{AgCl}(固)]}\)
[AgCl(固)]を一定とみなし、新しい定数としてKs(AgCl)を次のように定義する。
\(K_{\mathrm{s}}(\mathrm{\mathrm{AgCl}}) =\mathrm{[【1】]}\mathrm{[【2】]}\)
このKs(AgCl)を(塩化銀の)【3】という。
解答/解説:タップで表示
解答:【1】Ag+【2】Clー【3】溶解度積(【1】・【2】は順不同)
問3
塩化銀AgClの溶解度を求めよ。ただし、AgClの溶解度積は4.0×10-10(mol/L)2とする。
解答/解説:タップで表示
解答:2.0×10ー5(mol/L)
溶けるAgClをx(mol/L)とすると、Ag+、Cl–の濃度はどちらもx(mol/L)となる。
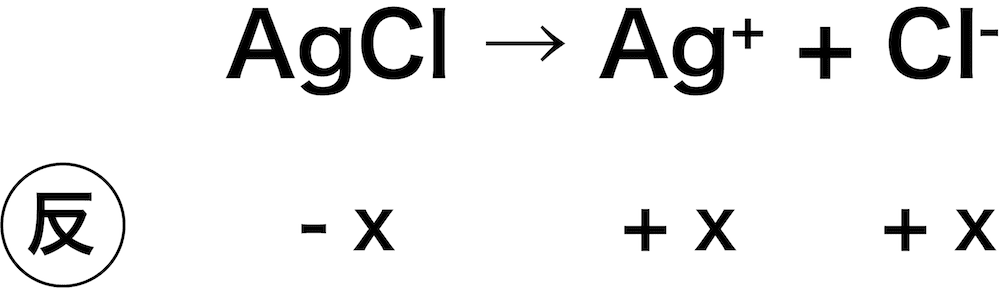
したがって、次のような式を立てることができる。
\[ K_{\mathrm{sp}}(\mathrm{AgCl}) = \mathrm{[Ag^{+}][Cl^{-}]}\\
\leftrightarrow 4.0×10^{-10} = x × x\\
\therefore x = 2.0×10^{-5}(\mathrm{mol/L}) \]