MENU
共有結合結晶【高校化学・化学基礎一問一答】
多数の原子が共有結合によって繋がってできる結晶を【1】という。
解答/解説:タップで表示
共有結合結晶は構成元素の種類と割合を最も簡単な整数比で示した【1】で表される。
解答/解説:タップで表示
ダイヤモンドCでは、炭素C原子がもつ【1】個の価電子が、隣り合うC原子の価電子と共有結合している。
解答/解説:タップで表示
ダイヤモンドの融点は非常に【1(高 or 低)】い。
解答/解説:タップで表示
ダイヤモンドは電気伝導性が【1(ある or ない)】。
解答/解説:タップで表示
ダイヤモンドの単位格子に含まれるC原子の数は【1】個である。
解答/解説:タップで表示
解答:【1】8
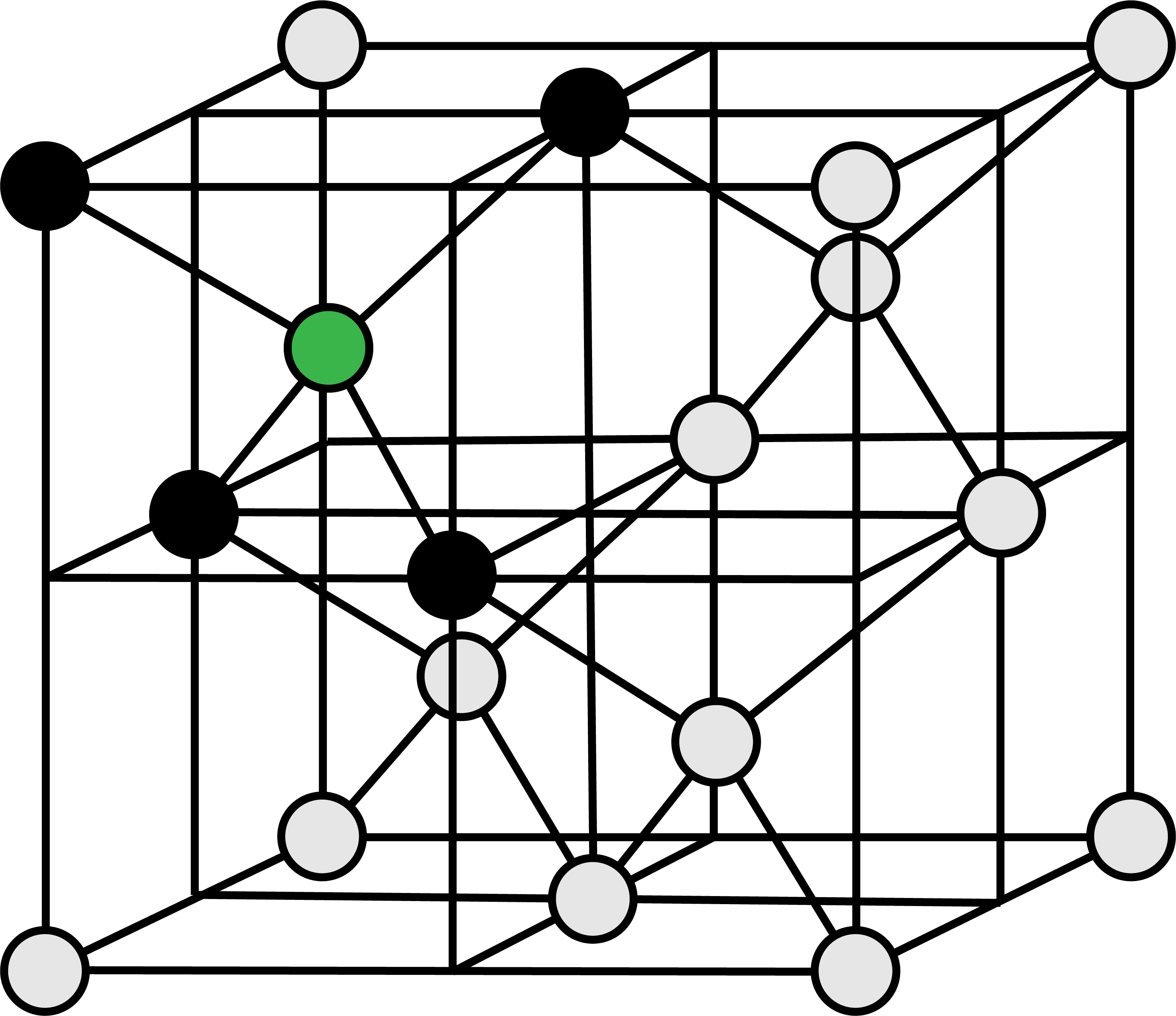
次の図は、ダイヤモンドの共有結合結晶の単位格子を表す。
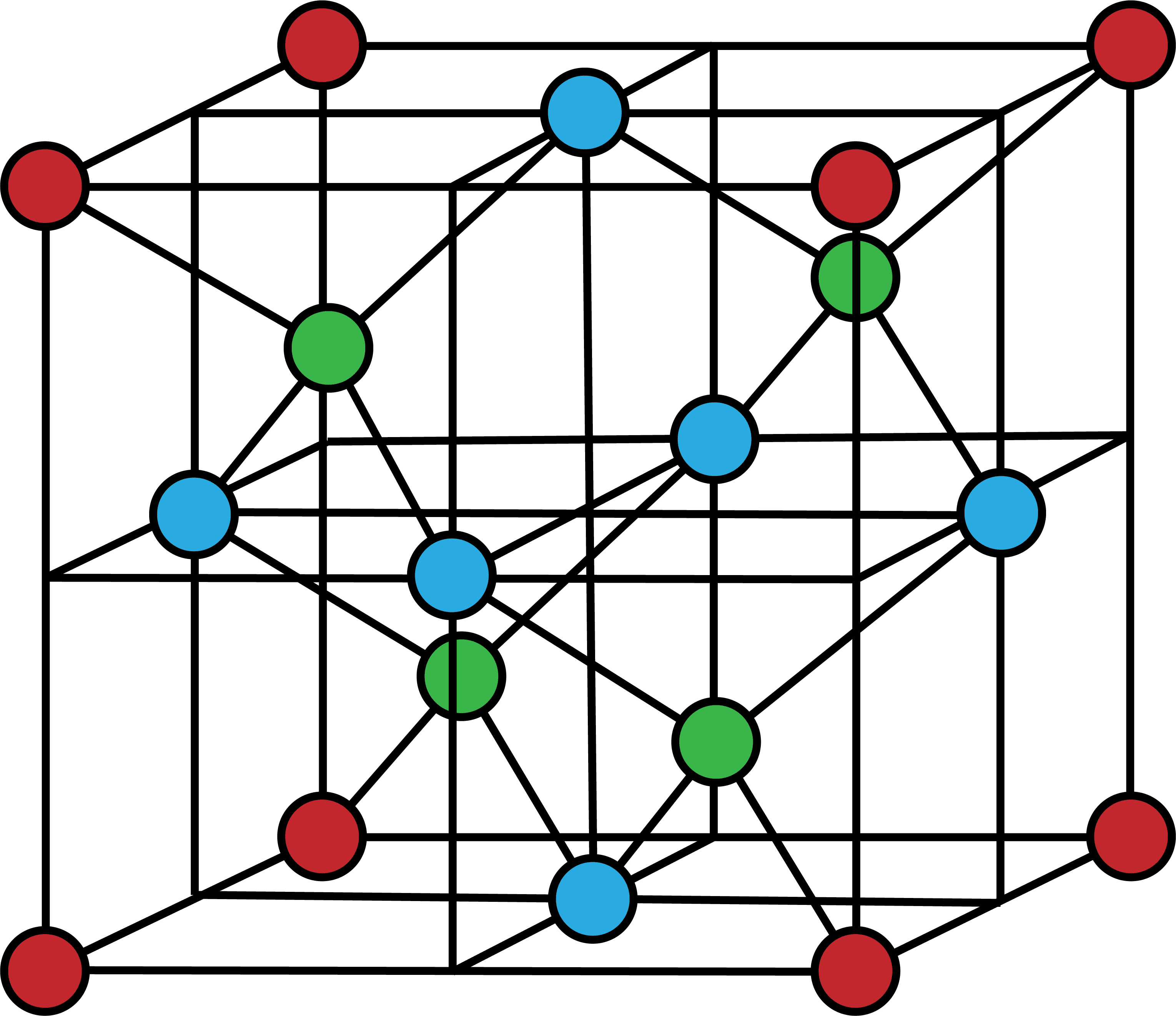
単位格子の頂点を占めるC原子(1/8)を赤、面上のC原子(1/2)を青、格子内部の丸々1個のC原子を緑で表している。
単位格子に含まれるC原子の数は8個である。
\[
\frac{ 1 }{ 8 }×8+\frac{ 1 }{ 2 }×6+1×4=8(個)
\]
ダイヤモンドの単位格子における配位数は【1】である。
解答/解説:タップで表示
黒鉛では、C原子がもつ4個の価電子のうち【1】個が共有結合に使われている。
解答/解説:タップで表示
解答:【1】3
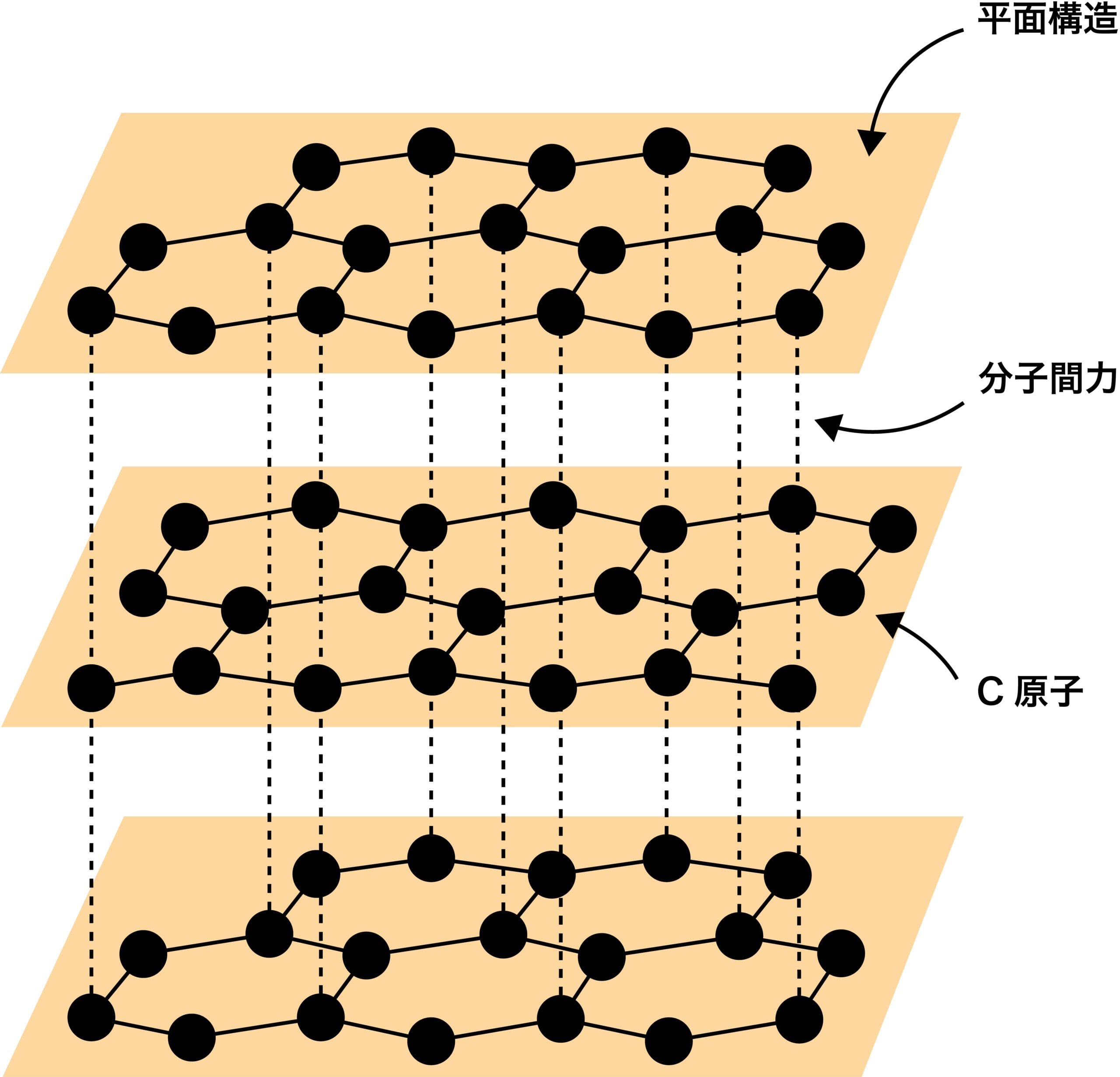
黒鉛は、C原子がもつ4個の価電子のうち3個のみを使って隣り合う炭素原子の価電子と共有結合し、正六角形の構造が繰り返された平面層状構造をつくっている。また、この平面層状構造同士が分子間力によって緩く結合している。
黒鉛は電気伝導性が【1(ある or ない)】。
解答/解説:タップで表示
黒鉛は【1】色である。
解答/解説:タップで表示
ダイヤモンドは【1(絶縁体 or 半導体)】、ケイ素は【2(絶縁体 or 半導体)】である。
解答/解説:タップで表示
解答:【1】絶縁体【2】半導体
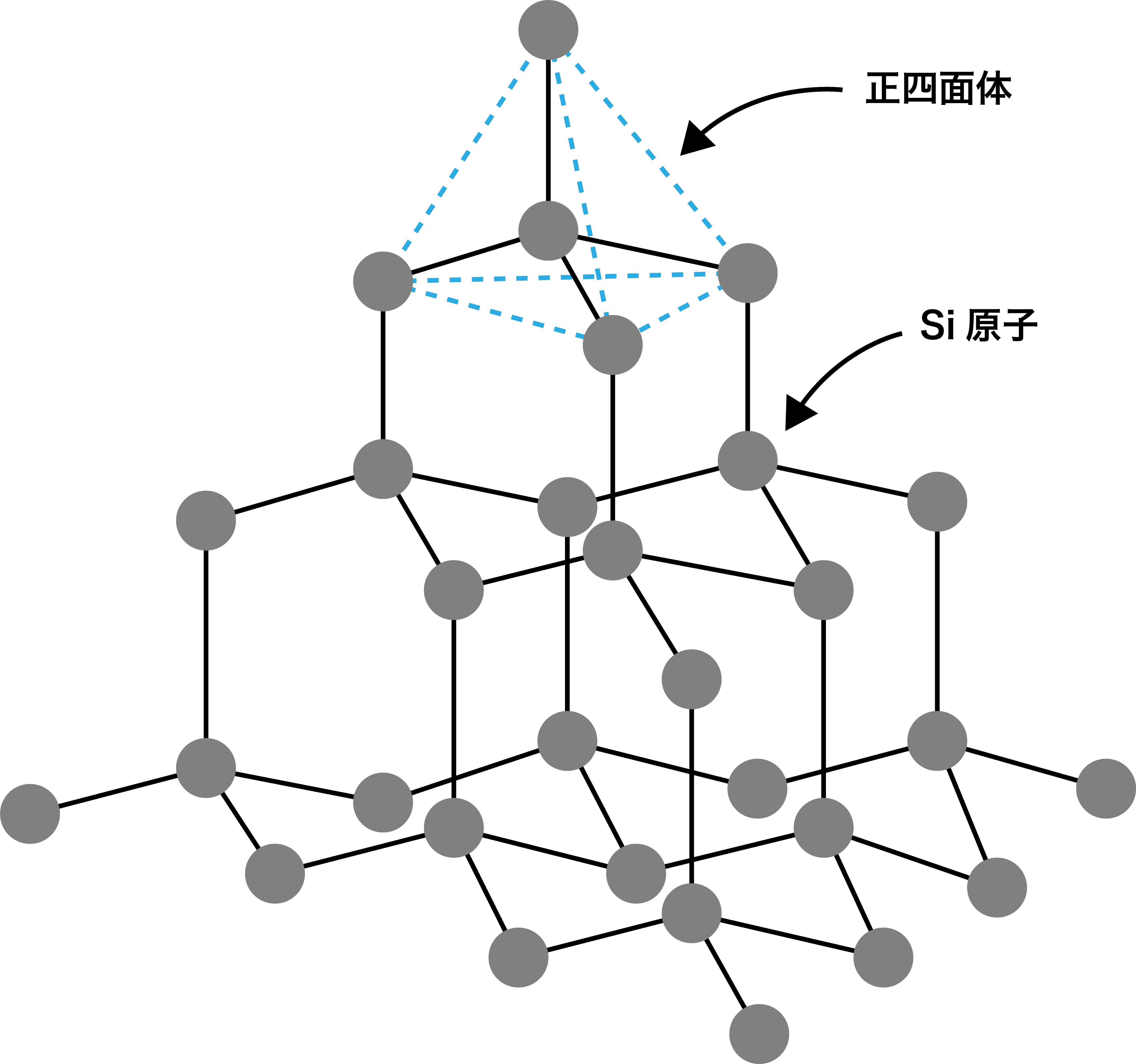
Si-Si結合は、ダイヤモンドのC-C結合に比べて弱く切れやすいため、ケイ素はやや電気を通す(半導体)。この性質を生かし、純度の高いケイ素はパソコン関係の部品や太陽光発電のパネルなどに用いられる。
二酸化ケイ素SiO2の共有結合結晶は、ケイ素Siの共有結合結晶に【1】原子を組み込んだ構造になっている。
解答/解説:タップで表示
解答:【1】酸素O
二酸化ケイ素SiO2の共有結合結晶は、ケイ素Siの共有結合結晶に酸素O原子を組み込んだ構造になっている。
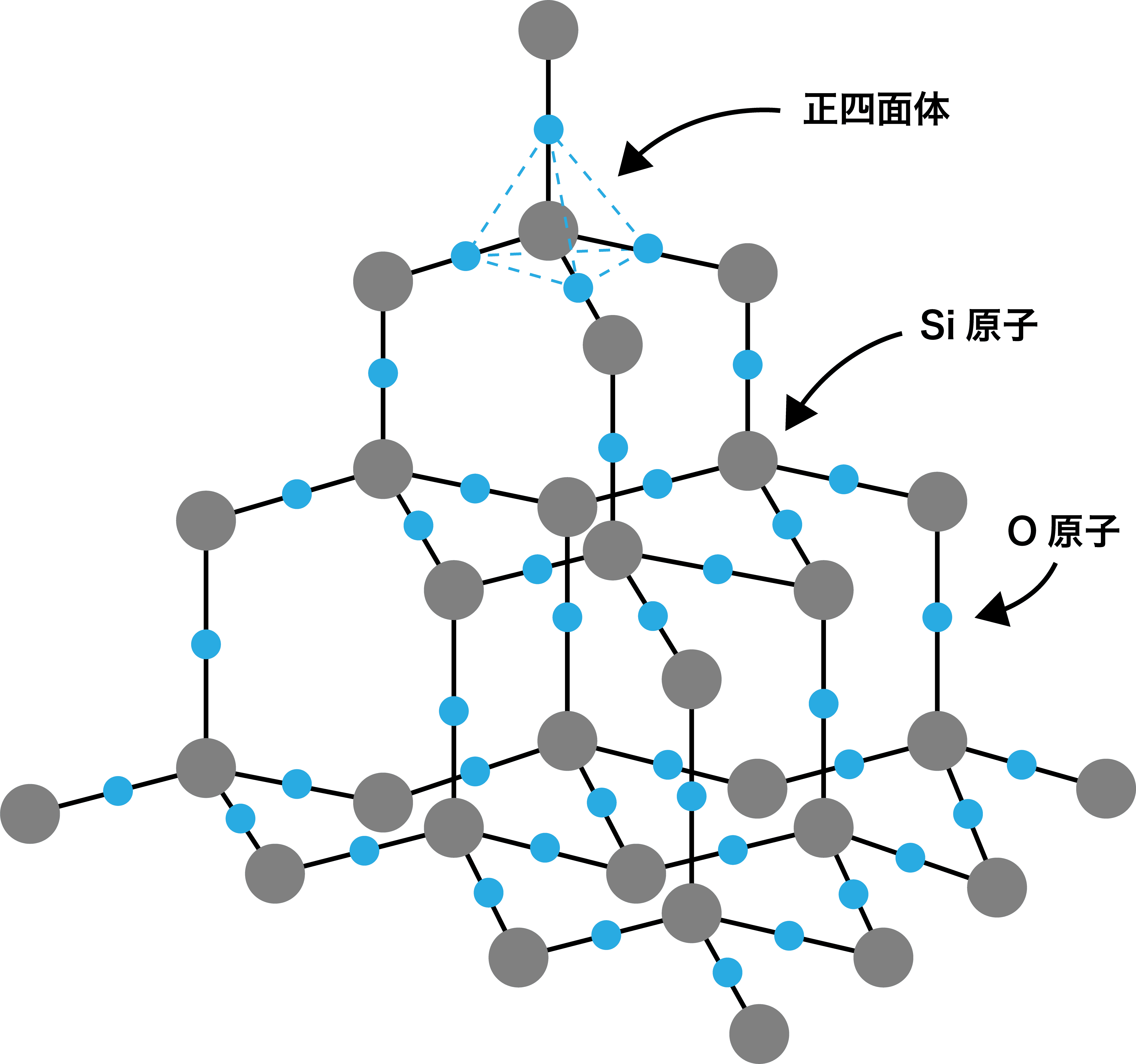
Si原子の正四面体構造のなかに、SiO4の正四面体構造が収まっているようなイメージである。