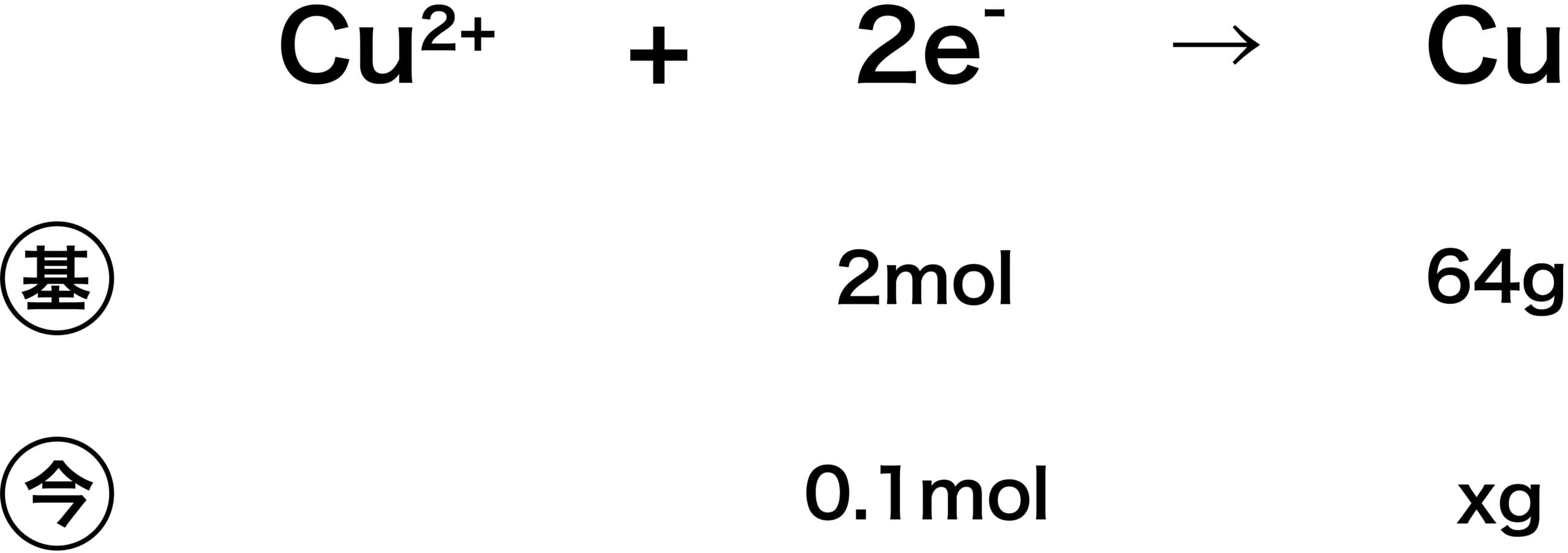MENU
電気量計算【高校化学・化学基礎一問一答】
電極で変化するイオンの物質量(mol)は流れた電気量(C)に比例する。これを【1】の法則という。
解答/解説:タップで表示
1Cは1Aの電流が1【1】間流れたときの電気量である。
解答/解説:タップで表示
解答:【1】秒
電気量はクーロン(C)とファラデー(F)の2つの単位で表される。
1Cは1アンペア(A)の電流が1秒間流れたときの電気量である。
\[ \mathrm{電気量(C) = 電流(A) × 時間(秒) }\]
1【1】は電子1molのもつ電気量である。
解答/解説:タップで表示
解答:【1】ファラデー(F)
1Fは電子1molのもつ電気量である。
\[ \mathrm{電気量(F) = 9.65 × 10^{4}(C/mol)} \]
ちなみに、この9.65×104という数値はファラデー定数とよばれる。
5Aの電流を3860秒間流したときに流れた電気量は【1】Cである。
解答/解説:タップで表示
解答:【1】19300
問題文に電流(A)と時間(秒)が書かれているため、まずはそれを使って流れた電気量(C)を求める。
\[ \mathrm{5(A)×3860(秒)=19300(C)} \]
問4のときに流れた電子eーの物質量は【1】molである。
解答/解説:タップで表示
解答:【1】0.2
問4で求めた電気量と、ファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 19300(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.2
\end{align} \]
次の反応において、9650Cの電気量を使用したときに流れた電子eーの物質量は何molか。
Cu2+ + 2eー → Cu
解答/解説:タップで表示
解答:0.1
電気量とファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 9650(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.1
\end{align} \]
問6のときに析出した銅Cuの質量は何gか。ただし、Cu=64とする。
解答/解説:タップで表示
次の反応において、3Aの電流を1930秒流したときに発生する酸素は標準状態で何Lか。
2H2O → O2 + 4H+ + 4eー
解答/解説:タップで表示
解答:0.336L
問題文に電流(A)と時間(秒)が書かれているので、まずはそれを使って流れた電気量(C)を求める。
\[ \mathrm{3(A)×1930(秒)=5790(C)} \]
次に、求めた電気量とファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 5790(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.06
\end{align} \]
最後に、反応量計算を行い、酸素の発生量を求める。

\[ 22.4:4=x:0.06\\
\leftrightarrow x=0.336(\mathrm{L}) \]