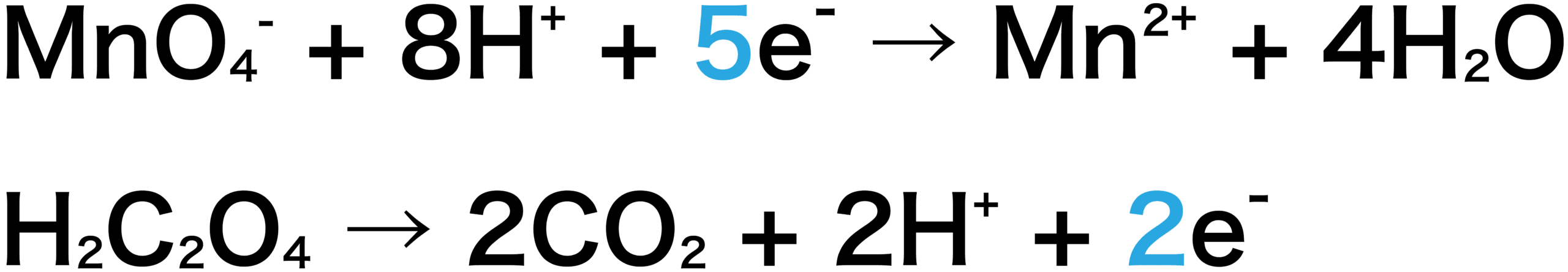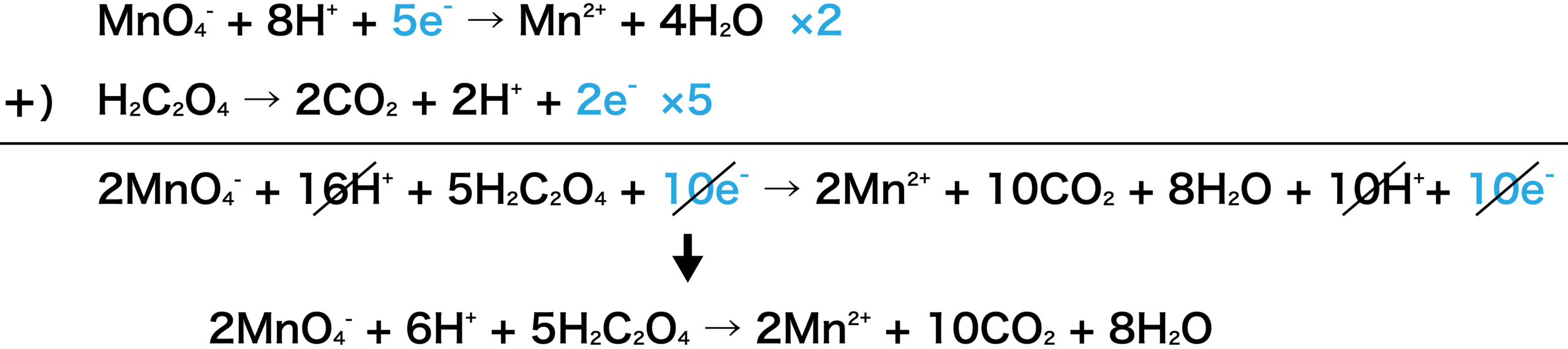MENU
酸化還元滴定【高校化学・化学基礎一問一答】
問1
硫酸酸性で濃度未知のシュウ酸水溶液500(ml)に0.50(mol/L)の過マンガン酸カリウム水溶液を滴下していく。200(ml)滴下したところで、色が赤紫色から変化しなくなった。このときのシュウ酸水溶液の濃度(mol/L)を求めよ(有効数字2桁で解答)。
解答/解説:タップで表示
解答:0.50mol/L
●STEP1
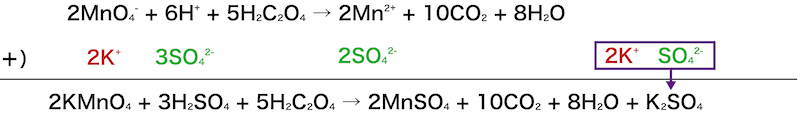
2つの半反応式から反応式を作成する。
●STEP2
「酸化剤が受け取るeー(mol)= 還元剤が放出するeー(mol)」を利用し、未知の濃度を求める。
STEP
2つの半反応式から反応式を作成する。
STEP
「酸化剤が受け取るeー(mol)= 還元剤が放出するeー(mol)」を利用し、未知の濃度を求める。
酸化還元反応では、還元剤の出した電子eーを酸化剤がそのまま受け取るので、次の式が成り立つ。
\[ \mathrm{酸化剤が受け取るe^{ー}(mol)= 還元剤が放出するe^{ー}(mol) }\]
したがって、今回の場合、次の式をつくることができる。
\[ \underbrace{ 0.50\mathrm{(\mathrm{mol/L})} × \frac{ 200 }{ 1000 }\mathrm{(L)} }
_{ \mathrm{KMnO_{4}}\text{ のmol }}
× 5
=
\underbrace{ x(\mathrm{mol/L}) × \frac{ 500 }{ 1000 }(\mathrm{L}) }
_{ \mathrm{H_{2}C_{2}O_{4}}\text{ のmol }}
× 2 \\
↔︎ x=0.50(\mathrm{mol/L}) \]
KMnO4とH2C2O4の半反応式より、KMnO41molが受け取るeーは5mol、H2C2O41molから出るeーは2molなので、左辺に5、右辺に2をかけていることに注意しよう。