MENU
極性【高校化学・化学基礎一問一答】
問1
異なる種類の原子が共有結合すると、共有電子対は電気陰性度が【1(大き or 小さ)】い原子の方へ引きつけられる。
解答/解説:タップで表示
問2
原子間の電気陰性度の差によって生じる電荷の偏りを【1】という。
解答/解説:タップで表示
問3
極性をもつ分子を【1】という。
解答/解説:タップで表示
問4
極性をもたない分子を【1】という。
解答/解説:タップで表示
問5
二酸化炭素の分子の形は【1】形である。
解答/解説:タップで表示
問6
二酸化炭素は【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
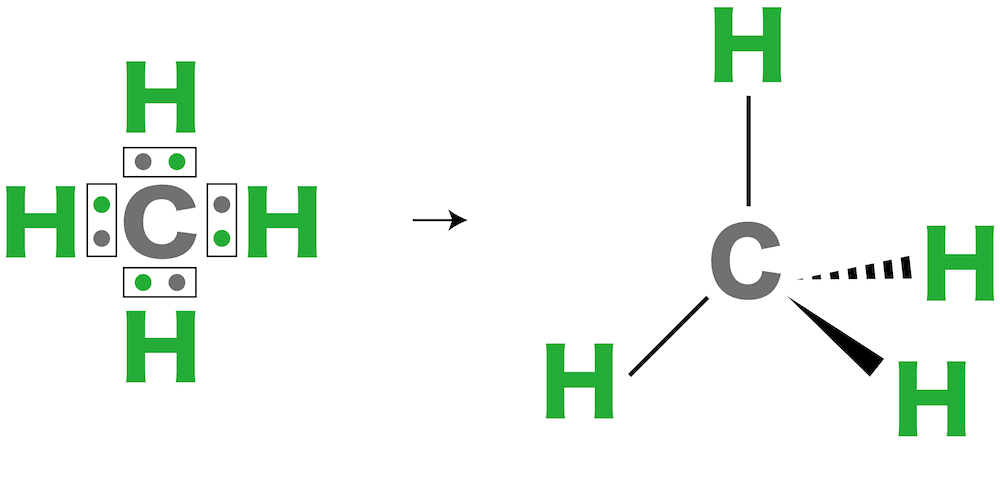
問7
メタンの分子の形は【1】形である。
解答/解説:タップで表示
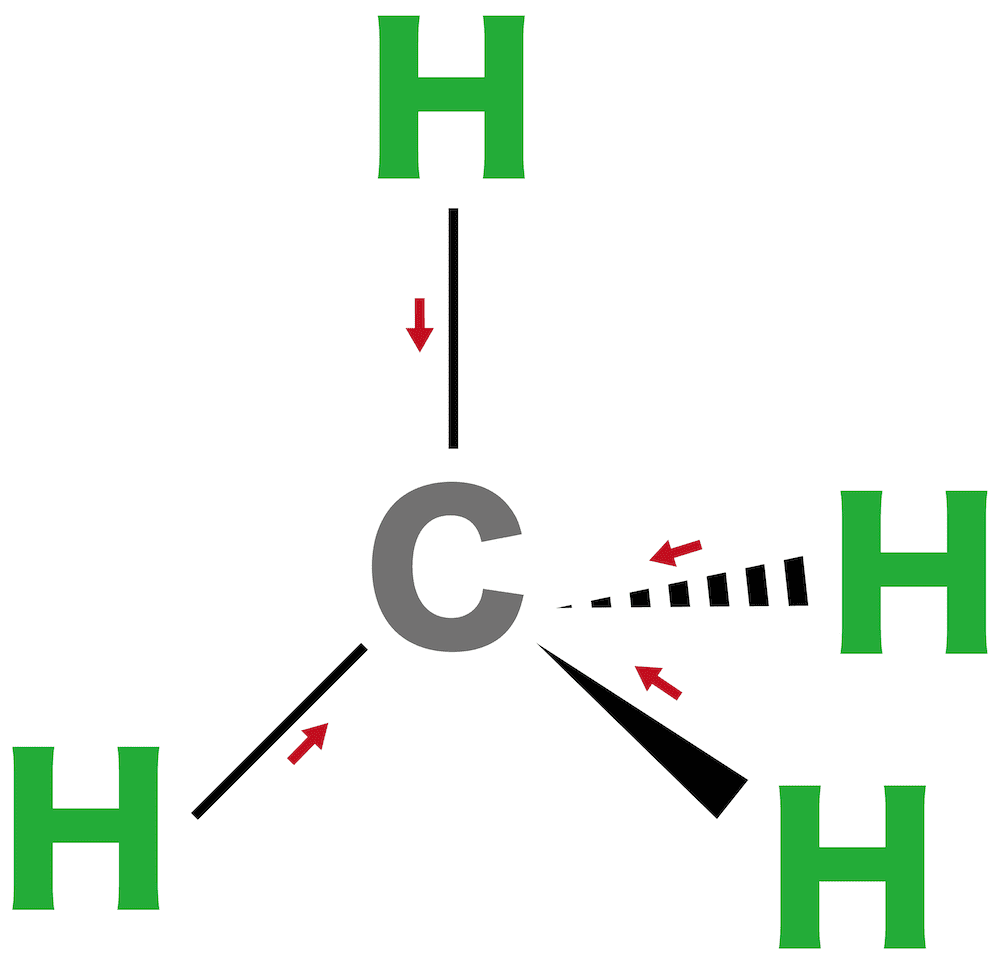
問8
メタンは【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
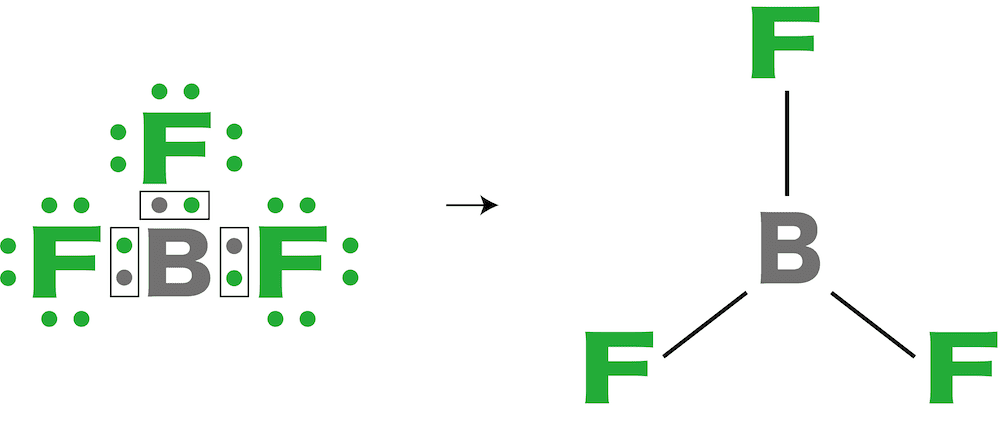
問9
三フッ化ホウ素の分子の形は【1】形である。
解答/解説:タップで表示
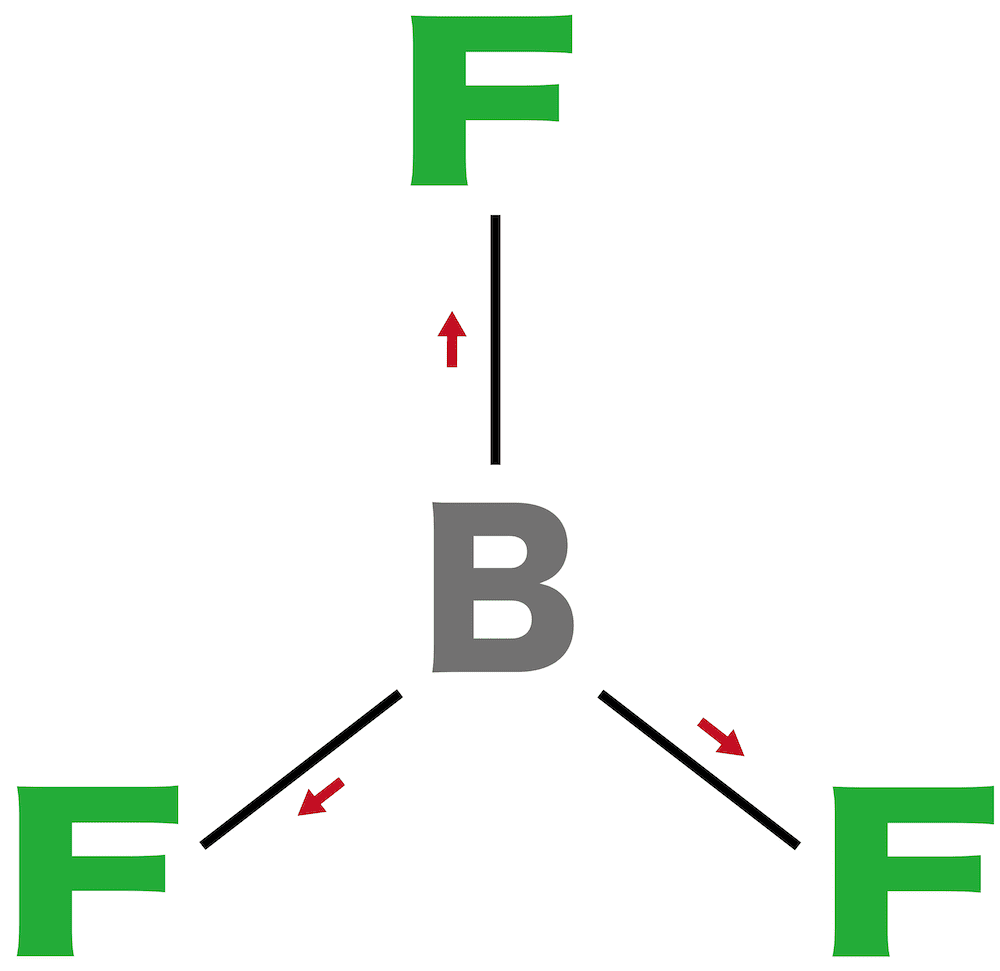
問10
三フッ化ホウ素は【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
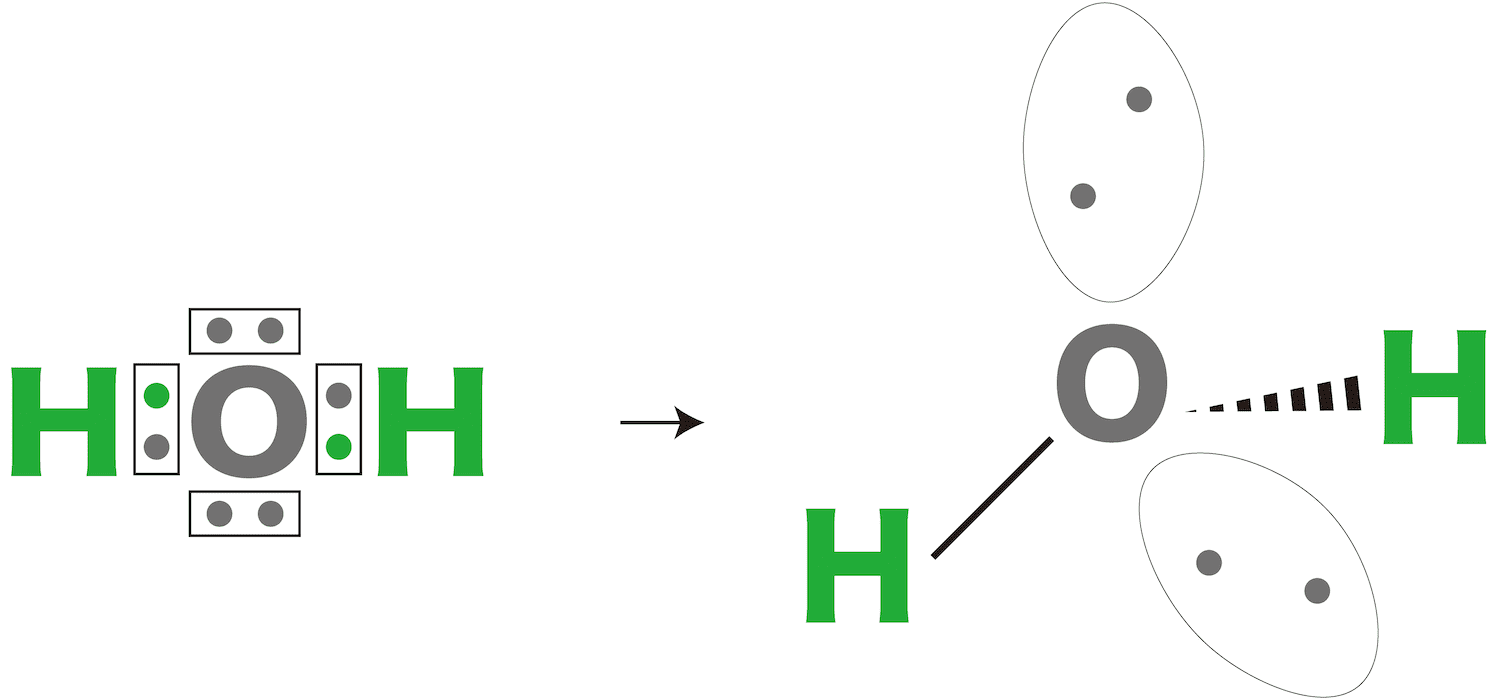
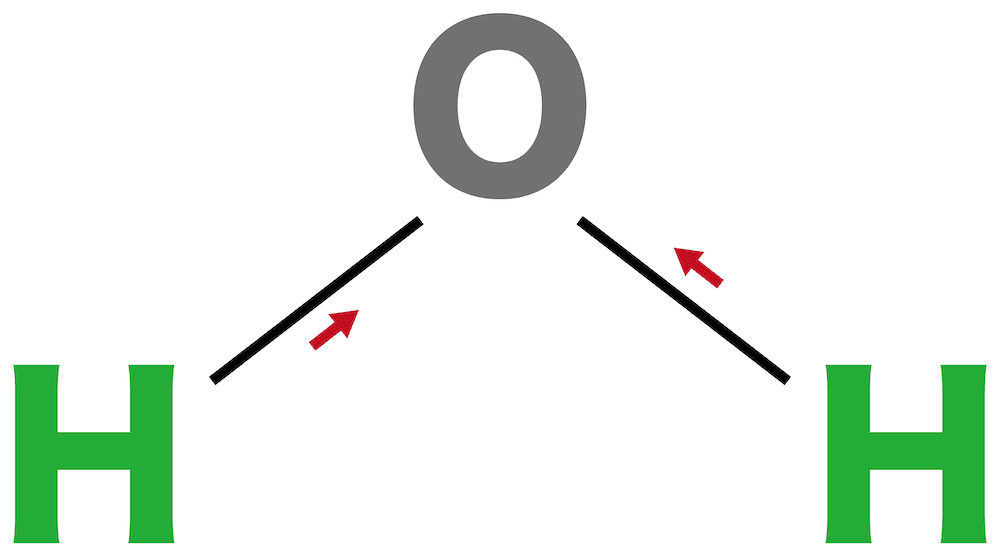
問11
水の分子の形は【1】形である。
解答/解説:タップで表示
問12
水は【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
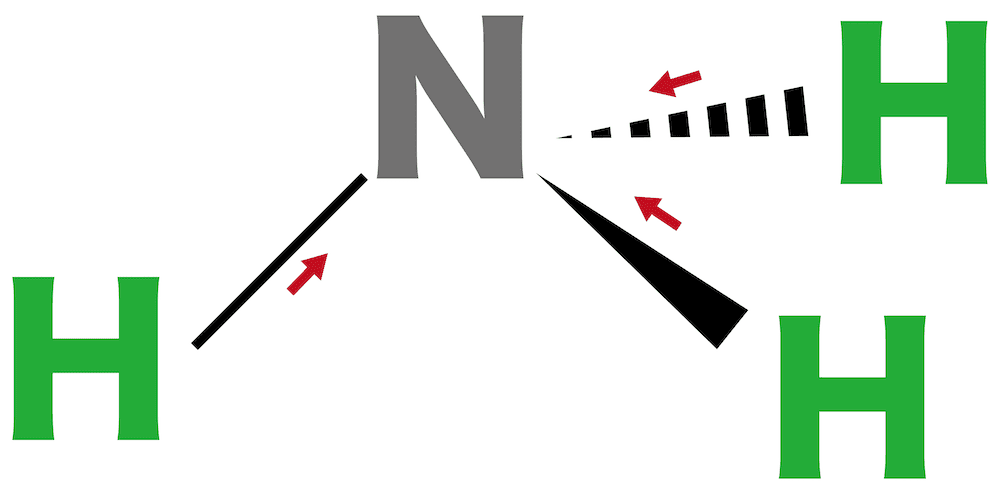
問13
アンモニアの分子の形は【1】形である。
解答/解説:タップで表示
問14
アンモニアは【1(極性 or 無極性)】分子である。