MENU
鉛蓄電池【高校化学・化学基礎一問一答】
鉛蓄電池の負極は【1】板、正極は【2】板である。
解答/解説:タップで表示
鉛蓄電池の電池式は次の通りである。
(ー)Pb|【1】|PbO2(+)
解答/解説:タップで表示
解答:【1】H2SO4
鉛蓄電池とは、鉛Pbと酸化鉛(Ⅳ)PbO2を希硫酸H2SO4に浸してできる電池である。
これを踏まえて、鉛蓄電池の電池式は次のように表すことができる。
\[ \mathrm{(-)Pb|H_{2}SO_{4}aq|PbO_{2}(+) }\]
鉛蓄電池の負極では鉛Pbの【1(酸化 or 還元)】反応が、正極では酸化鉛PbO2の【2(酸化 or 還元)】反応が起こる。
解答/解説:タップで表示
鉛蓄電池の放電時には、負極では【1】が酸化されて【2】が生じ、正極では【3】が還元されて【2】が生じる。【2】は電解質中の【4】とくっついて【5】を生成するため、鉛蓄電池は放電が進行すると両極に【5】が析出して電極が覆われる。電解質中の【4】は減少していくため電池の起電力は徐々に【6(増加 or 低下)】する。
解答/解説:タップで表示
解答:【1】鉛Pb【2】鉛(Ⅱ)イオンPb2+【3】酸化鉛(Ⅳ)PbO2【4】硫酸イオンSO42ー【5】硫酸鉛(Ⅱ)PbSO4【6】低下
鉛蓄電池の放電時には、負極では鉛Pbが酸化されて鉛(Ⅱ)イオンPb2+が生じ、正極では酸化鉛(Ⅳ)PbO2が還元されてPb2+が生じる。Pb2+は電解質中の硫酸イオンSO42ーとくっついて硫酸鉛(Ⅱ)PbSO4を生成するため、鉛蓄電池は放電が進行すると両極にPbSO4が析出して電極が覆われる。電解質中のSO42ーは減少していくため電池の起電力は徐々に低下する。
鉛蓄電池の負極で起こる変化を電子eーを用いた反応式で表せ。
解答/解説:タップで表示
解答:Pb + SO42ー → PbSO4 + 2eー
鉛蓄電池の負極では、Pb板が溶けてPb2+が発生する。
\[ \mathrm{Pb → Pb^{2+} + 2e^{-}} \]
Pb2+は溶液中のSO42ーと反応するので、両辺にSO42ーを足すと…
\[ \mathrm{Pb + SO_{4}^{2-} → PbSO_{4} + 2e^{-}} \]
これが、鉛蓄電池の負極の反応式である。
鉛蓄電池の正極で起こる変化を電子eーを用いた反応式で表せ。
解答/解説:タップで表示
解答:PbO2 + 4H+ + SO42ー + 2eー → PbSO4 + 2H2O
鉛蓄電池の正極では、PbO2板が、負極から流れてきたeーを受け取る。
\[ \mathrm{PbO_{2} + 4H^{+} + 2e^{-} → Pb^{2+} + 2H_{2}O} \]
負極同様、Pb2+は溶液中のSO42ーと反応するため、両辺にSO42ーを足すと…
\[ \mathrm{PbO_{2} + 4H^{+} + SO_{4}^{2-} + 2e^{-} → PbSO_{4} + 2H_{2}O} \]
これが、鉛蓄電池の正極の反応式である。
鉛蓄電池の全体の反応式を書け。
解答/解説:タップで表示
解答:Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
負極・正極の反応式を使って、鉛蓄電池全体の反応式をつくることができる。
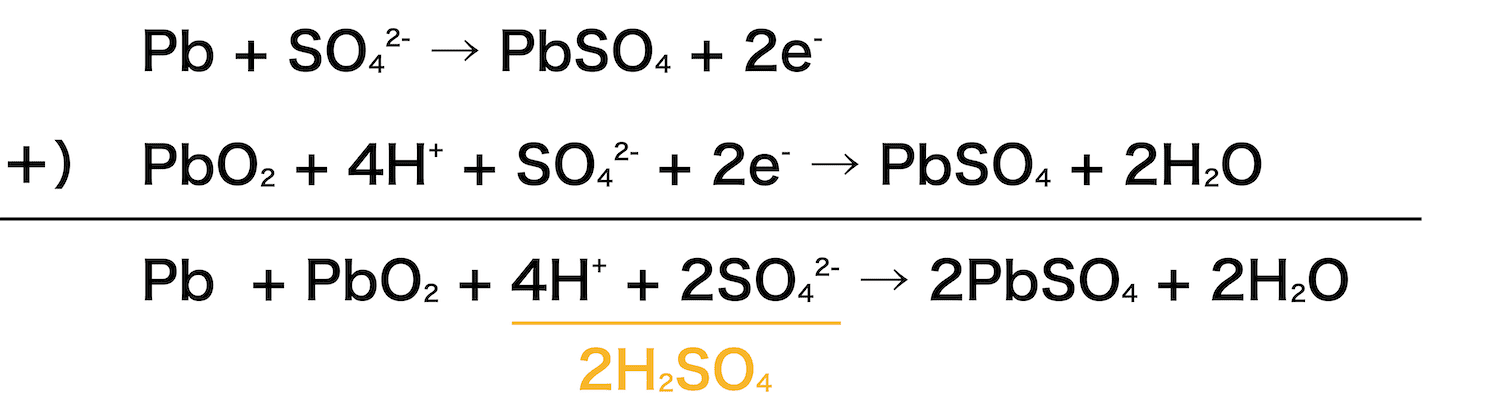
電子を負極から正極に流して電流を発生させることを【1】、それとは逆向きに電子を流すことを【2】という。
解答/解説:タップで表示
充電を行って繰り返し使用できる電池を【1】という。
解答/解説:タップで表示
充電ができず、繰り返し使うことができない電池を【1】という。














