MENU
イオンの大きさ(原子の場合と異なる理由・周期表での傾向など)
はじめに
【プロ講師解説】このページでは『イオンの大きさ(原子の場合と異なる理由・周期表での傾向など)』について解説しています。
イオン半径とは
- イオンの原子核から最外殻電子までの距離をイオン半径という。
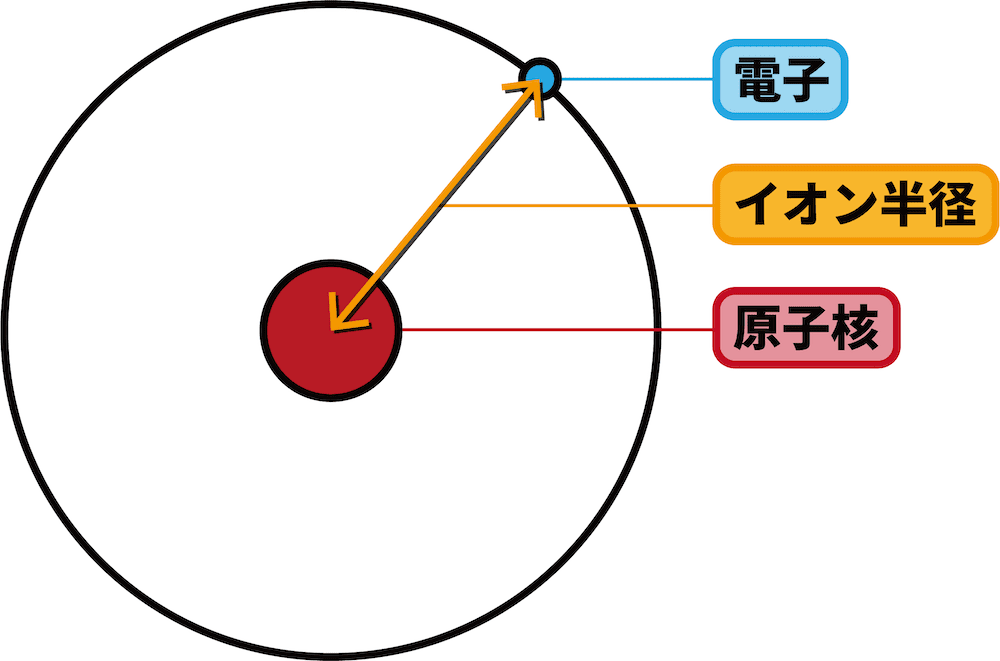
周期表の同族におけるイオン半径
- 周期表の同族(縦)において、イオン半径は下にいくほど大きくなる。
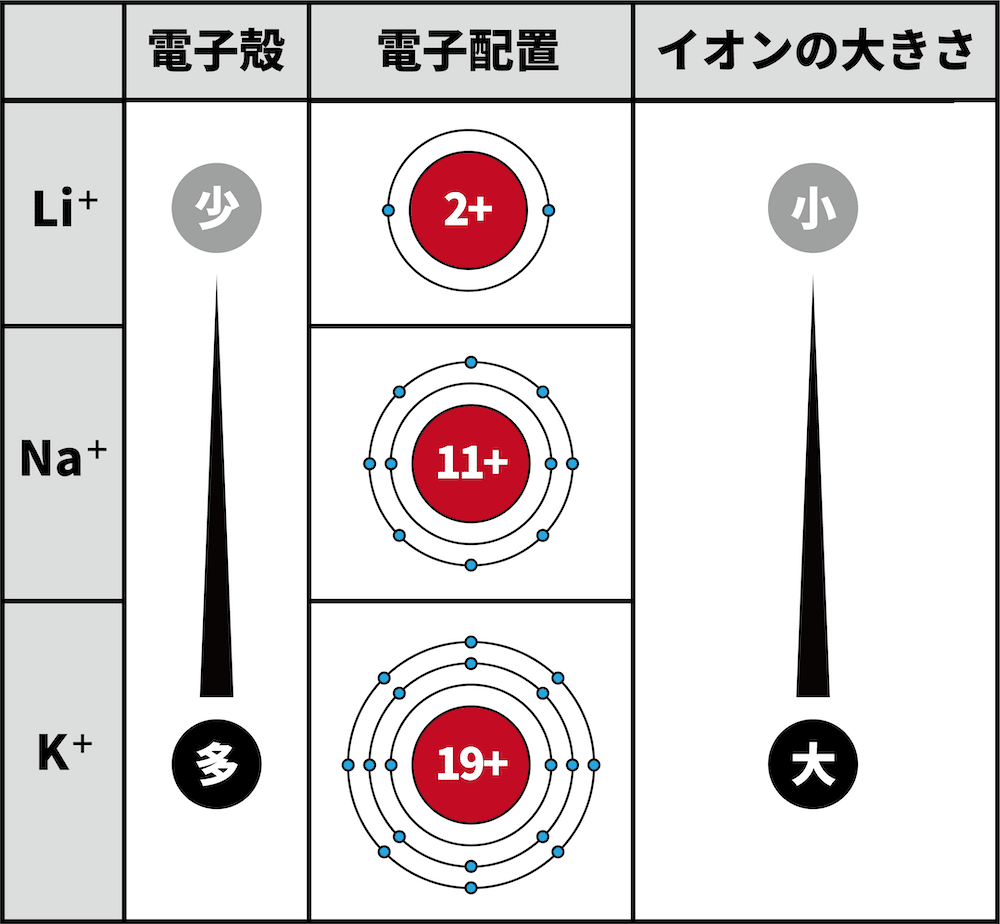
- 1族元素のイオンについて、Li+の最外殻はK殻、Na+の最外殻はL殻、K+の最外殻はM殻である。
- 電子殻が増えるほど、イオン半径は大きくなる。
- したがって、K殻までしか電子殻がないLi+よりもL殻まで電子殻があるNa+の方がイオン半径が大きい。同様に、L殻までしか電子殻がないNa+よりもM殻まで電子殻があるK+の方がイオン半径が大きい。
- つまり、周期表の下にいくほど電子殻が増え、イオン半径が大きくなる。
Ne型電子配置のイオン半径
- 希ガスであるネオンNeと同じ電子配置をもつイオンのイオン半径を考える。

- O2-、F-、Na+、Mg2+、Al3+はすべてNeと同じ電子配置(K殻2個・L殻8個)である。しかし、中心にある原子核中に含まれる陽子数は異なる。
- O2-は8個、F-は9個、Na+は11個、Mg2+は12個,Al3+は13個の陽子をもつ。
- 陽子数が多いほど電子を強く引きつけるため、イオン半径は小さくなる。したがって、イオン半径(イオンの大きさ)は次のようになる。
O2- > F- > Na+ > Mg2+ > Al3+
Ar型電子配置のイオン半径
- 希ガスであるアルゴンArと同じ電子配置をもつイオンのイオン半径を考える。
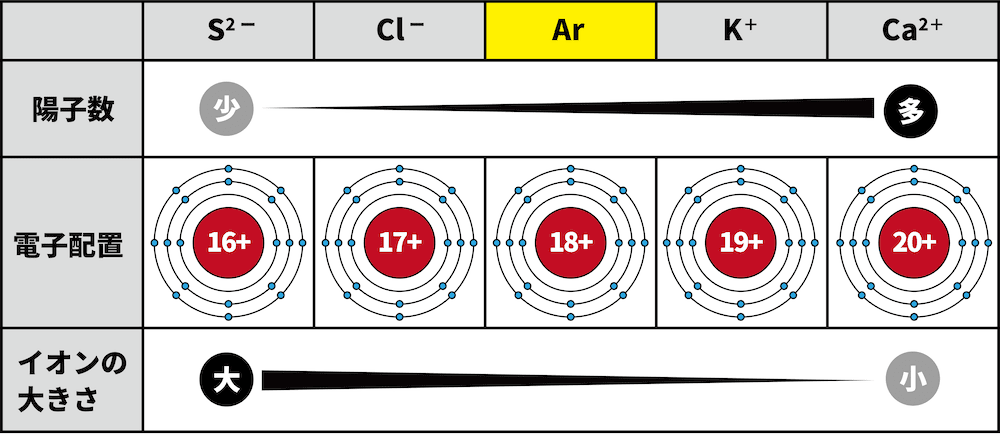
- S2-、Cl-、K+、Ca2+はすべてArと同じ電子配置(K殻2個,L殻8個,M殻8個)である。しかし、中心にある原子核中に含まれる陽子数は異なる。
- S2-は16個,Cl-は17個,K+は19個,Ca2+は20個の陽子をもつ。
- 陽子数が多いほど電子を強く引きつけるため、イオン半径は小さくなる。したがって、イオン半径(イオンの大きさ)は次のようになる。
S2- > Cl- > K+ > Ca2+
イオン半径まとめ
この『イオンの大きさ(原子の場合と異なる理由・周期表での傾向など)』のページで解説した内容をまとめる。
- イオンの原子核から最外殻電子までの距離をイオン半径という。
- 周期表の同族(縦)でイオン半径を比較する場合、下にいくほど大きくなる。
- ある希ガスの電子配置と同じ電子配置をもつイオンのイオン半径を比較する場合、陽子数が増えるほど小さくなる。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
イオンの原子核から最外殻電子までの距離を【1】という。
解答/解説:タップで表示
解答:【1】イオン半径
イオンの原子核から最外殻電子までの距離をイオン半径という。
Li+・Na+・K+をイオン半径の大きい順に並べよ。
解答/解説:タップで表示
解答:K+>Na+>Li+
周期表の同族(縦)において、イオン半径は下にいくほど大きくなる。
O2-・F-・Na+・Mg2+・Al3+をイオン半径の大きい順に並べよ。
解答/解説:タップで表示
解答:O2- > F- > Na+ > Mg2+ > Al3+
O2-は8個、F-は9個、Na+は11個、Mg2+は12個,Al3+は13個の陽子をもつ。
陽子数が多いほど電子を強く引きつけるため、イオン半径は小さくなる。したがって、イオン半径(イオンの大きさ)は次のようになる。
O2- > F- > Na+ > Mg2+ > Al3+
S2-・Cl-・K+・Ca2+をイオン半径の大きい順に並べよ。
解答/解説:タップで表示
解答:S2->Cl->K+>Ca2+
S2-、Cl-、K+、Ca2+はすべてArと同じ電子配置(K殻2個,L殻8個,M殻8個)である。しかし、中心にある原子核中に含まれる陽子数は異なる。
S2-は16個,Cl-は17個,K+は19個,Ca2+は20個の陽子をもつ。
陽子数が多いほど電子を強く引きつけるため、イオン半径は小さくなる。したがって、イオン半径(イオンの大きさ)は次のようになる。
S2- > Cl- > K+ > Ca2+














