MENU
【公式あり】中和計算を一瞬で解く方法を理由を交えて徹底解説!
はじめに
【プロ講師解説】このページでは『【公式あり】中和計算を一瞬で解く方法を理由を交えて徹底解説!』について解説しています。
中和とは
- 酸と塩基が反応すると、塩と水H2Oが生じる。この反応を中和という。
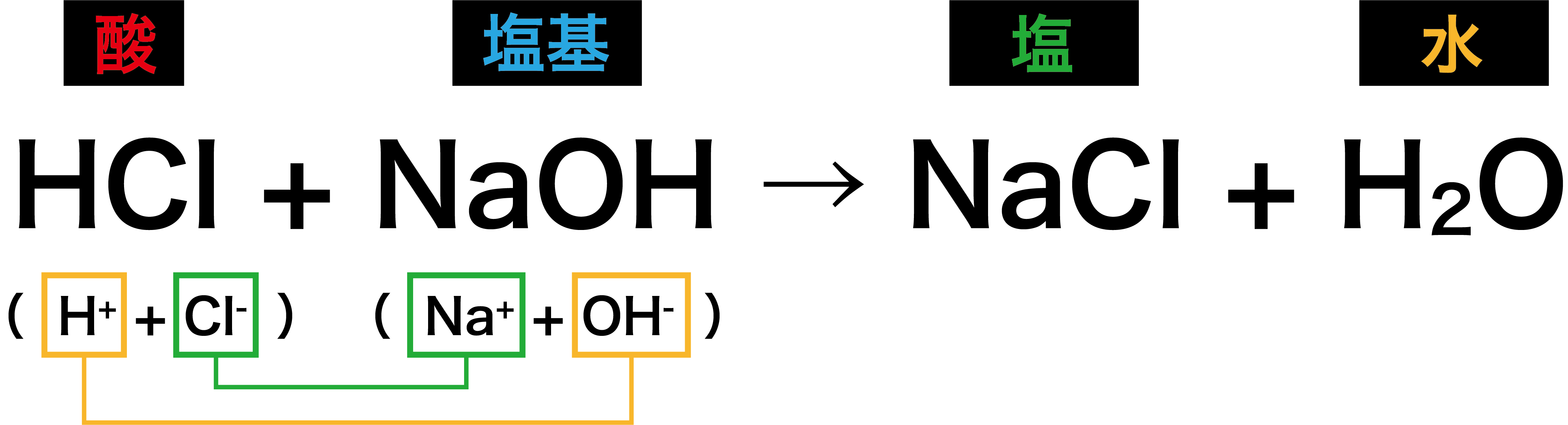
- 中和したとき、酸のもつH+と塩基のもつOHーが1個ずつ組み合わさり、H2Oが生じる。
- したがって、「中和する=酸由来のH+と塩基由来のOHーが等しくなる」と考えることができる。
酸に含まれるH+・塩基に含まれるOHー
- 酸に含まれるH+、塩基に含まれるOHーの物質量(mol)の求め方、および両者の関係について解説する。
酸に含まれるH+
- 硫酸H2SO4が1molあるとき、そこに含まれるH+は何molだろうか。
- H2SO4は2価の酸のため、含まれるH+の物質量(mol)は、H2SO4の物質量(mol)の2倍である。
\[ \begin{align}
\mathrm{H^{+}}&=1×2\\
&=2(\mathrm{mol})
\end{align} \]
- つまり、酸がもつH+の物質量(mol)は「酸の物質量(mol)×酸の価数」で求めることができる。
塩基に含まれるOHー
- 塩基に含まれるOHーの物質量(mol)も、酸に含まれるH+と同様に考えることができる。
- 水酸化カルシウムCa(OH)2は2価の塩基のため、含まれるOHーの物質量(mol)はCa(OH)2の物質量(mol)の2倍である。
\[ \begin{align}
\mathrm{OH^{-}}&=1×2\\
&=2(\mathrm{mol})
\end{align} \]
- つまり、塩基がもつOHーの物質量(mol)は「塩基の物質量(mol)×塩基の価数」で求めることができる。
酸に含まれるH+と塩基に含まれるOHーの関係
- 最初に説明したように、中和点について、酸由来のH+と塩基由来のOHーの物質量(mol)は等しい。
- したがって、中和点における酸に含まれるH+、塩基に含まれるOHーの物質量(mol)の関係は次のようになる。
\[ \underbrace{ \mathrm{酸のmol×酸の価数} }_{ \mathrm{H^{+}のmol }}=\underbrace{ \mathrm{塩基のmol×塩基の価数} }_{ \mathrm{OH^{-}のmol} } \]
中和計算
- 上で紹介した式を用いた中和計算の解き方について解説する。
0.10(mol/L)の硫酸H2SO42.0(L)を中和するために必要な0.20(mol/L)の水酸化ナトリウムNaOHは何(L)か。
- 問題で与えられている数値を公式に当てはめると、次のようになる。
\[ \begin{align}&酸の\mathrm{mol}×酸の価数=塩基の\mathrm{mol}×塩基の価数\\
\\
&↔︎\underbrace{ \mathrm{0.10(mol/L) × 2.0(L)} }
_{ \mathrm{H_{2}SO_{4}\text{ のmol }}}
×
\underbrace{ 2 }
_{ \text{ 価数 }}
=
\underbrace{\mathrm{ 0.20(mol/L)} × x(\mathrm{L})}
_{ \mathrm{NaOH\text{ のmol }}}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x=2.0(\mathrm{L})
\end{align}\]
中和計算まとめ
この『【公式あり】中和計算を一瞬で解く方法を理由を交えて徹底解説!』のページで解説した内容をまとめる。
- 中和する=酸由来のH+と塩基由来のOHーが等しくなる
- 酸のmol×酸の価数=塩基のmol×塩基の価数
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
0.20(mol/L)の塩酸HCl10(L)を中和するのに必要な0.40(mol/L)の水酸化ナトリウムNaOH水溶液は何(L)か。
解答/解説:タップで表示
解答:5.0L
\[ \begin{align}&\underbrace{ \mathrm{0.20(mol/L) × 10(L)} }
_{ \mathrm{HCl}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }}
=
\underbrace{\mathrm{ 0.40(mol/L) ×} x(\mathrm{L}) }
_{ \mathrm{NaOH}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=5.0(L)}
\end{align} \]
0.10(mol/L)の塩酸HCl2.0(L)を中和するのに必要な0.20(mol/L)の水酸化ナトリウムNaOH水溶液は何(L)か。
解答/解説:タップで表示
解答:1.0L
\[ \begin{align}&\underbrace{ \mathrm{0.10(mol/L) × 2.0(L) }}
_{ \mathrm{HCl}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }}
=
\underbrace{ \mathrm{0.20(mol/L) }× x(\mathrm{L}) }
_{ \mathrm{NaOH}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=1.0(L)}
\end{align}\]
0.40(mol/L)の塩酸HCl500(mL)を中和するのに必要な0.20(mol/L)の水酸化ナトリウムNaOH水溶液は何(L)か。
解答/解説:タップで表示
解答:1.0L
\[ \begin{align}&\underbrace{ \mathrm{0.40(mol/L) × \frac{ 500 }{ 1000 }(L)} }
_{ \mathrm{HCl}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }}
=
\underbrace{ \mathrm{0.20(mol/L) ×} x(\mathrm{L}) }
_{ \mathrm{NaOH}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=1.0(L)}
\end{align}\]
0.20(mol/L)の硫酸H2SO42.0(L)を中和するのに必要な0.20(mol/L)の水酸化ナトリウムNaOH水溶液は何(L)か。
解答/解説:タップで表示
解答:4.0L
\[ \begin{align}&\underbrace{ \mathrm{0.20(mol/L) × 2.0(L)} }
_{ \mathrm{H_{2}SO_{4}}\text{ のmol }}
×
\underbrace{ 2 }
_{ \text{ 価数 }}
=
\underbrace{ \mathrm{0.20(mol/L) ×} x(\mathrm{L}) }
_{ \mathrm{NaOH}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=4.0(L)}
\end{align}\]
0.30(mol/L)の水酸化ナトリウムNaOH水溶液2.0(L)を中和するのに必要な0.20(mol/L)の硫酸H2SO4は何(L)か。
解答/解説:タップで表示
解答:1.5L
\[ \begin{align}&\underbrace{ \mathrm{0.20(mol/L) × x(L) }}
_{ \mathrm{H_{2}SO_{4}}\text{ のmol }}
×
\underbrace{ 2 }
_{ \text{ 価数 }}
=
\underbrace{ \mathrm{0.30(mol/L) × 2.0(L) }}
_{ \mathrm{NaOH}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=1.5(L)}
\end{align}\]
0.10(mol/L)の塩酸HCl1.0(L)を中和するために水酸化ナトリウムNaOH水溶液を加えていった。すると2.0(L)加えたところでちょうど中和された。このとき加えた水酸化ナトリウムNaOH水溶液の濃度は何(mol/L)か。
解答/解説:タップで表示
解答:0.050mol/L
\[ \begin{align}&\underbrace{ \mathrm{0.10(mol/L) × 1.0(L)} }
_{ \mathrm{HCl}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }}
=
\underbrace{ x\mathrm{(mol/L) × 2.0(L)} }
_{ \mathrm{NaOH}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=0.050(mol/L)}
\end{align}\]
0.050(mol/L)の硫酸H2SO44.0(L)を中和するために水酸化ナトリウムNaOH水溶液を加えていった。すると1.0(L)加えたところでちょうど中和された。このとき加えた水酸化ナトリウムNaOH水溶液の濃度は何(mol/L)か。
解答/解説:タップで表示
解答:0.40mol/L
\[ \begin{align}&\underbrace{\mathrm{ 0.050(mol/L) × 4.0(L) }}
_{ \mathrm{H_{2}SO_{4}}\text{ のmol }}
×
\underbrace{ 2 }
_{ \text{ 価数 }}
=
\underbrace{ x\mathrm{(mol/L) × 1.0(L) }}
_{ \mathrm{NaOH}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=0.40(mol/L)}
\end{align}\]
0.20(mol/L)の水酸化カルシウムCa(OH)2水溶液3.0(L)を中和するために硫酸H2SO4を加えていった。すると1.0(L)加えたところでちょうど中和された。このとき加えた硫酸H2SO4の濃度は何(mol/L)か。
解答/解説:タップで表示
解答:0.60mol/L
\[ \begin{align}&\underbrace{ x\mathrm{(mol/L) × 1.0(L)} }
_{ \mathrm{H_{2}SO_{4}}\text{ のmol }}
×
\underbrace{ 2 }
_{ \text{ 価数 }}
=
\underbrace{ 0.20\mathrm{(mol/L) × 3.0(L) }}
_{ \mathrm{Ca(OH)_{2}}\text{ のmol }}
×
\underbrace{ 2 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=0.60(mol/L)}
\end{align}\]
0.10(mol/L)の水酸化バリウムBa(OH)2水溶液200(ml)を中和するために硫酸H2SO4を加えていった。すると4.0(L)加えたところでちょうど中和された。このとき加えた硫酸H2SO4の濃度は何(mol/L)か。
解答/解説:タップで表示
解答:0.0050mol/L
\[ \begin{align}&\underbrace{ x\mathrm{(mol/L) × 4.0(L)} }
_{ \mathrm{H_{2}SO_{4}}\text{ のmol }}
×
\underbrace{ 2 }
_{ \text{ 価数 }}
=
\underbrace{ 0.10\mathrm{(mol/L) × \frac{ 200 }{ 1000 }(L)} }
_{ Ba(OH)_{2}\text{ のmol }}
×
\underbrace{ 2 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=0.0050(mol/L)}
\end{align}\]
0.050(mol/L)の塩酸HCl4.0(L)を中和するために水酸化ナトリウムNaOH水溶液を加えていった。すると2.0(L)加えたところでちょうど中和された。このとき加えた水酸化ナトリウムNaOH水溶液の濃度は何(mol/L)か。
解答/解説:タップで表示
解答:0.10mol/L
\[ \begin{align}&\underbrace{ \mathrm{0.050(mol/L) × 4.0(L) }}
_{ \mathrm{HCl}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }}
=
\underbrace{ x\mathrm{(mol/L) × 2.0(L)} }
_{ \mathrm{NaOH}\text{ のmol }}
×
\underbrace{ 1 }
_{ \text{ 価数 }} \\
\\
&↔︎ x\mathrm{=0.10(mol/L)}
\end{align}\]













