MENU
混合気体の燃焼と体積に関する問題の解き方
目次
はじめに
【プロ講師解説】このページでは『混合気体の燃焼と体積に関する問題の解き方』について解説しています。
例題1「水素/アセチレン/一酸化炭素の混合気体の燃焼」
問題
水素H2、アセチレンC2H2、一酸化炭素COの混合気体Aがある。A50mLに酸素60mLを加え、これらを完全燃焼させたところ体積は37.5mLになった。燃焼後の気体を水酸化ナトリウム水溶液に通すと体積は12.5mLになった。Aに含まれていたアセチレンの体積は何mLか。有効数字2ケタで答えよ。ただし、体積は全て25℃、1.0×105Paのもとで測定し、生じた水は全て液体で、その体積は無視していいものとする。
『上智大学 2005年 参考』
- まず、わからない値である水素・アセチレン・一酸化炭素の体積をそれぞれx・y・zとする。
\[\begin{align}&水素の体積 = x \mathrm{(ml)}\\
&アセチレンの体積 = y\mathrm{(ml)}\\
&一酸化炭素の体積 = z\mathrm{(ml)} \end{align}\]
- 問題文に水素・アセチレン・一酸化炭素の混合気体の体積は50mLであるとの記載があるので、これを使って1つ式をつくろう。
\[ x + y + z = \mathrm{50(ml)} \]
- 次に、それぞれの燃焼に関する反応式をつくる。
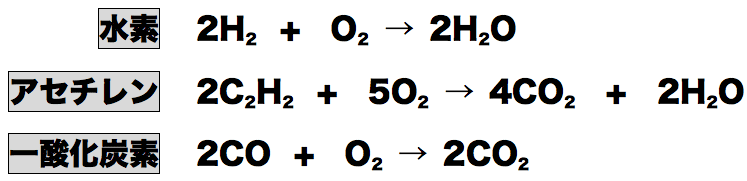
- 混合気体を燃焼させた段階で、水素の燃焼、及びアセチレンの燃焼から水H2Oが発生していることがわかる。問題文の最後に「生じた水は全て液体」と書いてあるので、燃焼後に残っている気体の体積37.5mLの中には水は含まれておらず「発生したCO2と余ったO2の混合気体」が37.5mLと考えることができる。
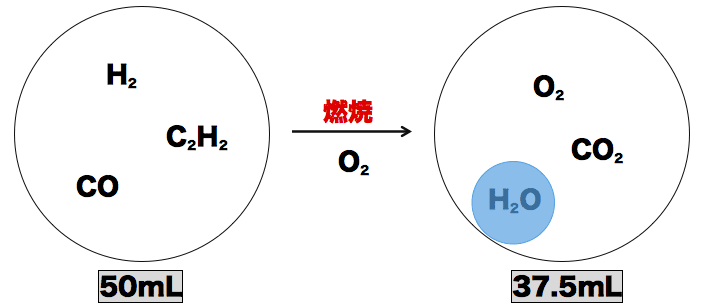
- また、この後「発生したCO2と余ったO2の混合気体」を(塩基性である)水酸化ナトリウム溶液に通しており、これにより(酸性である)CO2は取り除かれるので、最終的に余った気体12.5mLは「余ったO2」のみである。
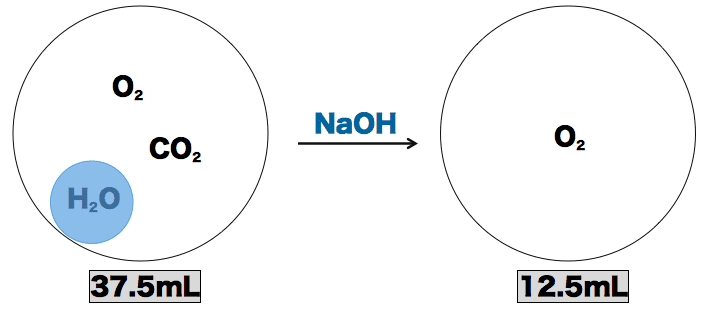
- 水素の体積がx、アセチレンの体積がy、一酸化炭素の体積がzであることを考慮すると、反応式の係数比から各物質の体積を次のように求めることができる。
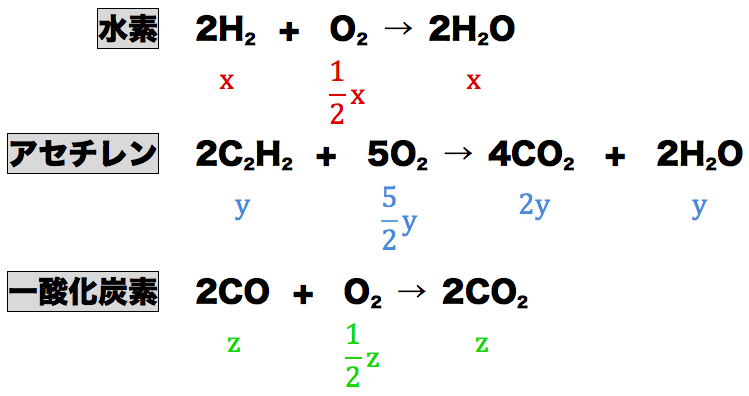
- 先ほど説明した通り、最終的に余った気体12.5mLは「余ったO2」のみなので、次のような式をつくることができる。
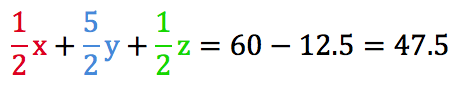
- 最初に入れたO2(60mL)から、余ったO2(12.5mL)を引けば、反応に使われたO2の体積が求まるよね。
- それでは、導き出した2つの式を連立して計算すると…
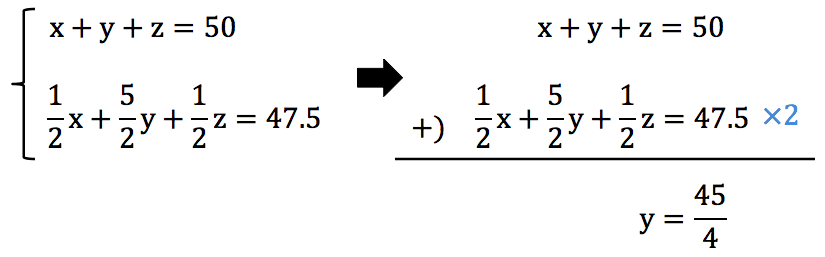
例題2「メタン/プロパンの混合気体の燃焼」
問題
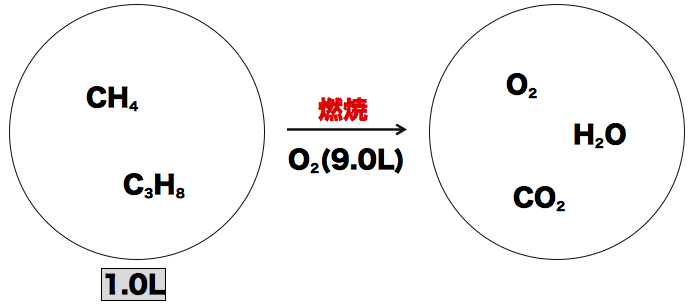
常温でメタンCH4とプロパンC3H8の混合気体1.0Lに9.0Lの酸素を混合して完全燃焼させたところ、メタンとプロパンは完全燃焼させたところ、メタンとプロパンは全て反応した。生成物をもとの温度に戻した時の体積は7.4Lであった。はじめの混合気体中に含まれていたメタンとプロパンはそれぞれ何molか求めよ。
『東京女子大学 参考』
- まず、問題文の意味を正確に理解しよう。
- メタンCH4とプロパンC3H8の混合気体にO2を入れて加熱すると、CO2とH2Oが発生する。
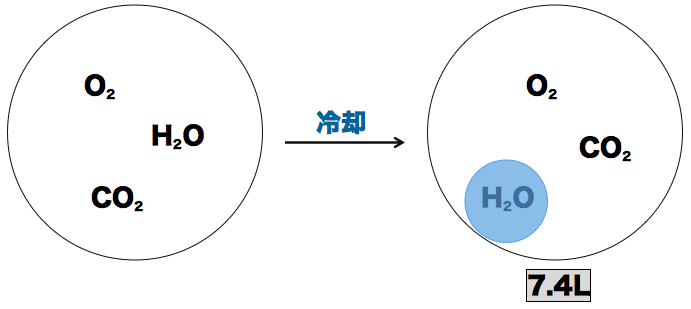
- CO2とH2OとO2の混合気体を冷却すると、水蒸気として存在していたH2Oが液体に変わる。したがって、問題文に書いてある気体の体積である7.4Lは「CO2とO2の体積の和」ということになる。(液体になっているH2Oは無視!)
- それでは、反応式を使って計算していく。
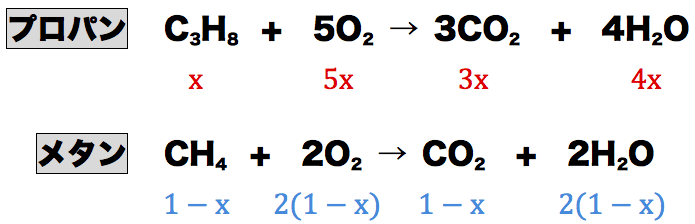
- CH4とC3H8の混合気体の体積は1.0(L)と問題に書かれているので、CH4の体積をx(L)とすると、CH4の体積は1.0ーx(L)と表すことができる。また、それらをもとに係数比を見て他の物質の体積も上のようにxを使って表すことができる。
- 次に、最初に説明したように、最後に気体として残っているのは生成したCO2とO2の2つなので、これらの体積をxで表す。

- 繰り返すが、最後に残っている気体はCO2とO2なので、これらの体積を足せば7.4Lになるはずである。

- これを解いて…















