MENU
分体積・全体積
はじめに
【プロ講師解説】このページでは『分体積・全体積』について解説しています。
分体積とは
- 気体Aと気体Bの混合気体を圧力Pと温度Tを一定のまま、成分ごとに分けたとする。
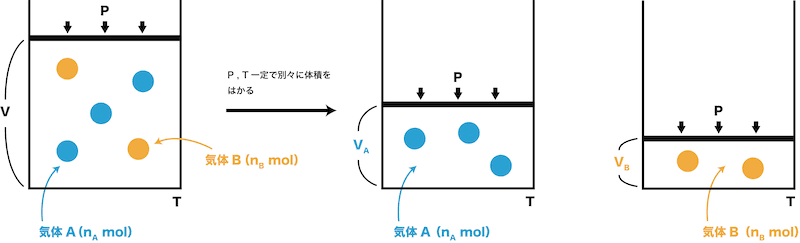
- このとき、気体Aの体積(VA)、気体Bの体積(VB)を分体積という。
- それぞれの分体積は気体の状態方程式PV=nRTを使って次のように表すことができる。
\[ \begin{align}
&V_{A}=\frac{ RT }{ P }・n_{A}・・・①\\
&V_{B}=\frac{ RT }{ P }・n_{B}・・・②
\end{align} \]
- 気体Aの分体積と気体Bの分体積を合わせた、混合気体の体積を全体積(P全)という。
\[ V_{全}=\frac{ RT }{ P }(n_{A}+n_{B})・・・③ \]
分体積と全体積の関係
- 体積Vと温度Tが一定のとき、上の①〜③式中のRT/Pは一定なのでCと置く。すると、①〜③式は次のように書くことができる。
\[ \begin{align}
&V_{A}=C・n_{A}・・・④ \\
&V_{B}=C・n_{B}・・・⑤ \\
&V_{全}=C(n_{A}+n_{B})・・・⑥
\end{align} \]
- ④〜⑥式より、全体積と分体積の関係は次のように表すことができる。
\[ V_{全}=V_{A}+V_{B} \]
モル分率
- 混合気体の物質量に対する特定の気体の物質量の割合をモル分率という。
- 全体積にモル分率をかけることで、その気体の分体積を求めることができる。
\[ V_{A}=V_{全}×\frac{ n_{A} }{ n_{A}+n_{B} } \]
上式の導出
\[ \begin{align}
&V_{A}=C・n_{A}・・・④ \\
&V_{B}=C・n_{B}・・・⑤ \\
&V_{全}=C(n_{A}+n_{B})・・・⑥
\end{align} \]
- ④〜⑥式より、Vが2倍になればnも2倍に、Vが半分になればnも半分になる。つまり、「体積比=モル比」が成り立っている。
- このとき、混合気体と気体A、混合気体と気体Bの体積とモル数の関係は、次のようになる。
\[ \begin{align}
&V_{全}:V_{A}=n_{A}+n_{B}:n_{A} \\
&V_{全}:V_{B}=n_{A}+n_{B}:n_{B}
\end{align} \]
- これを踏まえると、次のような式を導くことができる。
\[ \begin{align}
&V_{A}=V_{全}×\frac{ n_{A} }{ n_{A}+n_{B} }\\
&V_{B}=V_{全}×\frac{ n_{B} }{ n_{A}+n_{B} }
\end{align} \]
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
圧力が一定の容器に、一定温度で0.30molの水素H2と0.60molの酸素O2を入れたところ、容器内の気体の体積は6.0Lとなった。このときのH2とO2の分体積をそれぞれ求めよ。
解答/解説:タップで表示
解答:VH2:2.0L VO2:4.0L
次の公式を用いる。
\[ V_{A}=V_{全}×\frac{ n_{A} }{ n_{A}+n_{B} } \]
まずは、水素の分体積VH2を求める。
\[ \begin{align} V_{H_{2}}&=V_{全}×\frac{ n_{H_{2}} }{ n_{H_{2}}+n_{O_{2}} }\\
&=6.0×\frac{ 0.30 }{ 0.30+0.60 }\\
&=2.0(\mathrm{L}) \end{align} \]
次に、酸素の分体積VO2を求める。
\[ \begin{align} V_{O_{2}}&=V_{全}×\frac{ n_{O_{2}} }{ n_{H_{2}}+n_{O_{2}} }\\
&=6.0×\frac{ 0.60 }{ 0.30+0.60 }\\
&=4.0(\mathrm{L}) \end{align} \]
圧力1.5×105Paの容器に0.20molの水素H2と0.30molの窒素N2を入れて27℃にした。このときの混合気体の全体積、またH2とN2の分体積をそれぞれ求めよ(気体定数R=8.3×103とする)。
解答/解説:タップで表示
解答:V全:8.3L VH2:3.3L VN2:5.0L
まずは、気体の状態方程式を使って全体積を求める。
\[ \begin{align} PV&=nRT\\
V&=\frac{ nRT }{ P }\\
&=\frac{ 0.50×8.3×10^{3}×(27+273) }{ 1.5×10^{5} }\\
&=8.3(\mathrm{L}) \end{align} \]
次に、全体積にH2とN2それぞれのモル分率をかけることで分体積を求める。
\[ \begin{align}V_{H_{2}}&=V_{全}×\frac{ n_{H_{2}} }{ n_{H_{2}}+n_{N_{2}} }\\
&=8.3×\frac{ 0.20 }{ 0.20+0.30 }\\
&=3.32(\mathrm{L})\end{align} \]
\[ \begin{align}V_{N_{2}}&=V_{全}×\frac{ n_{N_{2}} }{ n_{H_{2}}+n_{N_{2}} }\\
&=8.3×\frac{ 0.30 }{ 0.20+0.30 }\\
&=4.98(\mathrm{L}) \end{align} \]






